Andreas Güldner, M.D., Thomas Kiss, M.D., Ary Serpa Neto, M.D., M.Sc., Ph.D.,
Sabrine N. T. Hemmes, M.D., Jaume Canet, M.D., Ph.D., Peter M. Spieth, M.D.,
Patricia R. M. Rocco, M.D., Ph.D., Marcus J. Schultz, M.D., Ph.D., Paolo Pelosi, M.D., F.E.R.S.,
Marcelo Gama de Abreu, M.D., M.Sc., Ph.D., D.E.S.A.
Журнал Anesthesiology 2015; 123:692-713
Оригинал статьи
Перевод: Колядко Андрей Васильевич, ординатор первого года, анестезиолог-реаниматолог кафедры факультетской хирургии Медицинского Института Сургутского Государственного Университета (МИ СурГУ). Публикуется с согласия автора.
Навигация по статье
Определение и прогнозирование ПОЛО
Стратегия механической вентиляции, защищающая легкие во время хирургического вмешательства
Последние данные в пользу интраоперационной протективной вентиляции
Выводы
Ссылки
Аннотация
Послеоперационные легочные осложнения ассоциируются с ростом смертности, длительностью пребывания в стационаре и смертностью после обширных оперативных вмешательств. Интраоперационная механическая вентиляция может снизить частоту ПослеОперационных Легочных Осложнений (далее ПОЛО). В данном обзоре рассматривается соответствующая литература по определению и методам предупреждения ПОЛО, патофизиология вентилятор-индуцированного легочного повреждения (далее ВИЛП) с акцентом на не поврежденных легких и протективную вентиляцию (касательно роли низких дыхательных объемов, ПДКВ и рекрутмент-манёвров). Авторы предлагают алгоритм протективной вентиляции, основанный на доказательствах недавних рандомизированных контролируемых исследованиях (далее РКИ).
ПОЛО увеличивают летальность, но могут быть редуцированы легочно-протективной механической вентиляцией. Различные стратегии использования низких дыхательных объемов, ПДКВ, рекрутмент-маневров и их комбинаций были предложены, но лишь немногие из них основаны на доказательствах. Этот обзор предлагает алгоритм протективной вентиляции, основанный на данных самых последних исследований.
ПОЛО имеют важное влияние на смертность пациентов, нуждающихся в обширных хирургических вмешательствах.(1) Практически 5% пациентов, подвергшихся хирургическим вмешательствам, и с развившимся ПОЛО, умирают в течение 30 дней. Более того, число ПОЛО четко ассоциируется с длительностью пребывания в стационаре, ранней и поздней летальностью.(1, 2)
Появляется всё больше доказательств, что интраоперационная легочно-протективная вентиляция, использующая низкие объемы, с (или без) высоким ПДКВ и рекрутмент маневрами, предотвращает ПОЛО, по сравнению с механической вентиляцией высокими объемами, низким уровнем ПДКВ и без рекрутмента.(3-6)
В настоящей статье мы рассматриваем определение и методы предотвращения ПОЛО, патофизиологию вентилятор-индуцированного легочного повреждения (ВИЛП) с акцентом на неповреждённых легких, и стратегию вентиляции для минимизации ПОЛО. Для определения наиболее современных доказательств из литературы, касающейся интраоперационной вентиляции, и клинических и не клинических послеоперационных исходов, мы изучили MEDLINE, используя запросы: «более низкий дыхательный объем», «низкий дыхательный объем», «протективная вентиляция», «рекрутмент маневр», «ПДКВ», или «положительное давление конца выдоха». Выбранные статьи и перекрестные ссылки в них были исследованы на предмет соответствующей информации.
Определение и прогнозирование ПОЛО
Текущие определения
Постоперационные легочные осложнения обычно представляются виде совокупности, которая включает возможные фатальные и не фатальные послеоперационные респираторные события, не существовавшие ранее. В данный момент нет согласия на счет того какие «события» должны считаться ПОЛО, например дыхательная недостаточноть, легочное повреждение, пневмония, пролонгированная или незапланированная механическая вентиляция легких, или интубация, гипоксемия, ателектазы, бронхоспазм, превральный выпот, пневмоторакс, снижение вентиляции, аспирационный пневмонит.(7, 8) Понятно, что все эти события могут иметь разные патофизиологические механизмы. По этой причине некоторые исследования фокусируются на конкретных осложнения, в первую очередь дыхательная недостаточность(9) и пневмония.(10)
ПОЛО, как таковые, должны быть связаны с анестезией и/или операцией. Более того, временные рамки должны быть четко определены. Обычно осложнения рассматриваются в качестве ПОЛО, если развились в пределах 5-7 дней после операции.(8, 11)

послеоперационных легочных осложнений.
Прогнозирование ПОЛО
Прогнозирование ПОЛО или других послеоперационных осложнений может быть полезно в плане предоперационной подготовки с целью предотвратить их, и снизить затраты системы здравоохранения.(12) В-первую очередь должны быть определены факторы риска, связанные с развитием ПОЛО. В 2006 American College of Physicians опубликовал систематический обзор литературы, касающейся факторов риска ПОЛО с соответствующим уровнем доказательности.(13) Последние годы этот список был расширен включением обнаруженных факторов, которые повышают риск ПОЛО. Таблица 1 демонстрирует факторы риска, ассоциированные с ПОЛО, согласно литературе. Около 50% факторов риска ПОЛО связаны с состоянием здоровья пациентов, остальные 50 связаны с хирургической процедурой, анестезией. (1)

Были разработаны различные шкалы, основанные на факторах риска, и потенциально прогнозирующие случаи ПОЛО,(6, 14-16) как показано в Таблице 2. Однако их применимость, возможно, ограничена, потому что они были получены из ретроспективных данных, или подтверждены только для конкретных ПОЛО.(6, 14) Исследование The Asses Respiratory Risk in Surgical Patients in CATalonia (ARISCAT) было проведено среди хирургических пациентов Каталонии, Испания.(1) После многомерного анализа, созданная шкала была основана на семи факторах риска, была проверена и показала клинически значимое прогнозирование (c-statistic, 0.90). Недавно шкала ARISCAT была исследована внешне на большой европейской выборке (the Prospective Evaluation of a Risk Score for Postoperative Pulmonary COmPlications in Europe study).(2) Несмотря на различия в подсчете баллов между различными районами Европы, шкала показала способность разграничивать 3 уровня риска ПОЛО (низкий, средний и высокий). Таким образом, в будущем шкала ARISCAT может представлять наиболее ценный инструмент для прогнозирования в разных странах и среди хирургических пациентов.
Предполагаемые механизмы развития ВИПЛ
Сосуществование закрытых, рекрутабельных и уже перерастянутых альвеол делает легкие уязвимыми к вредным эффектам механического повреждения и напряжения, индуцированного механической вентиляцией.(19, 20) Физические силы в некоторых альвеолах могут уже превышать эластичность легких, несмотря на то, что примерное давление в дыхательных путях (обычно мониторируется) всё ещё будет в рамках «безопасной» зоны. (21, 22) Несколько механизмов были обозначены для описания развития ВИПЛ. (23) Повышение давления в дыхательных путях (баротравма), применение высоких дыхательных объемов (волюмтравма) могут быть причиной повреждения или разрушения альвеолярных эпителиальных клеток, путем возникновения транспульмонального давления которые превышает эластичность легких (деформация).(24, 25) Было показано, что продолжительность механического повреждения влияет на развитие легочного воспалительного ответа.(26)
Механическая вентиляция может вызвать повреждения коллабированных и вновь открытых альвеол, феномен известен как ателектотравма.(27) Все три механизма – баротравма, волюмтравма, ателектотравма – влияет на эпителий альвеол и эндотелий сосудов(28, 29) и способствует разрушению внеклеточного матрикса.(30, 31)
Внеклеточный матрикс легочной паренхимы особенно чувствителен к стрессу механической вентиляции, как показано на рисунке 1. Первоначально протеогликаны со стороны эндотелия и в прослойке между эндотелием и эпителий повреждаются в зависимости от дыхательного объема, (30) и от дыхательного паттерна.(31) Механическая фрагментация внеклеточного матрикса способствует интерстициальному отеку, активации металлопротеиназ, и дальнейшему повреждению матрикса. На втором этапе фрагменты экстрацеллюлярного матрикса активируют воспалительные медиаторы.(32, 33) Более того, повреждение внеклеточного матрикса механической вентиляцией может быть усилено жидкостной нагрузкой,(34) что не редкость во время общей анестезии. Однако перегрузка жидкостью, кажется, может минимизировать воспалительный ответ, вероятно, путем разбавления фрагментов внеклеточного матрикса или изменением их структуры, тем самым снижая локальный воспалительный ответ,(34) Это говорит о том, что, во-первых: повреждение механической вентиляцией делает легкие более восприимчивым к дальнейшим повреждениям, во-вторых: в прежде здоровых легких ВИПЛ может быть вызвано и без раннего подъема уровня медиаторов воспаления.
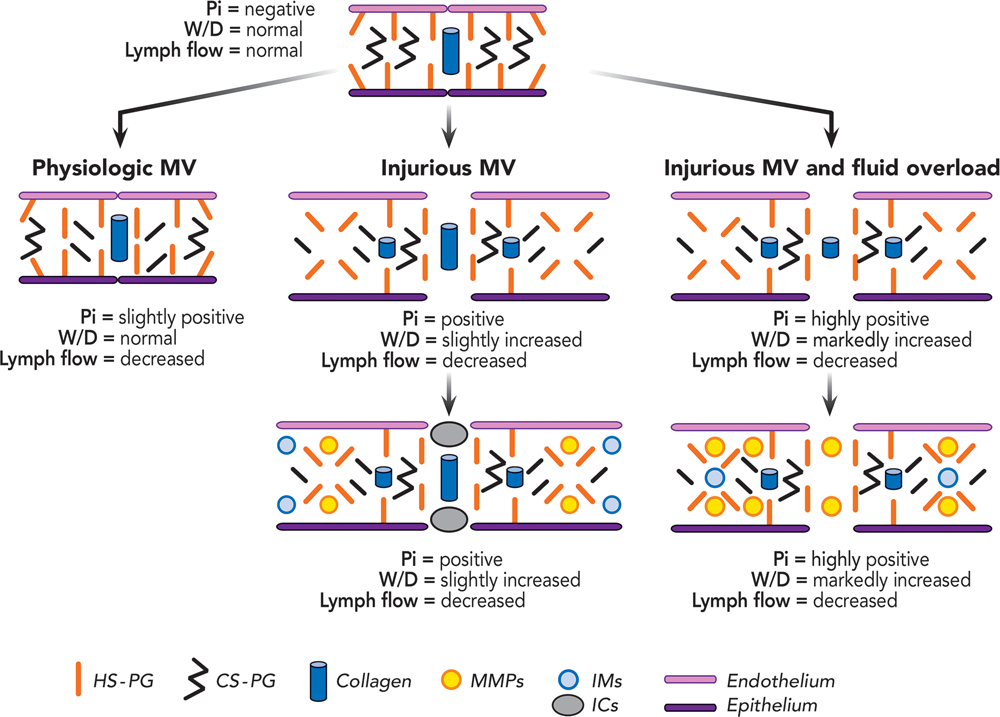
На клеточном уровне физический раздражитель становится химическим сигналом, например, провоспалительные или противовоспалительные медиаторы путем прямого повреждения клеток или опосредованной активацией клеточного сигнального пути. Этот процесс известен как «механотрансдукция» (mechanotransduction).(35) Некоторые медиаторы могут способствовать локальным эффектам (проапоптотический, профибротический), в то время как другие рекрутируют клетки иммунной популяции (нейтрофилы и макрофаги).(36) Эти локальные эффекты, равно как и иммунологические последствия, собраны в понятие «биотравма».(37)
Кроме внеклеточного матрикса так же и эндотелий и эпителий находятся под влиянием напряжения и деформации, происходящих по причине механической вентиляции. В эндотелии высокое напряжение может привести к прямому повреждению клеток, что приведет к капиллярному повреждению. (38, 39) Более того, механический стресс, равно как и воспалительные стимулы (например ФНО-альфа), может быть триггером разрушения цитоскелета,(40) ведущее к увеличению проницаемости эндотелия и отек.(41) Аналогично легочному эндотелию, механическое напряжение и деформация увеличивает проницаемость и альвеолярного эпителия,(42) феномен, обнаруженный при вентиляции как высокими,(43) так и малыми(44) объемами. Плюс ко всему, вентиляция низкими объемами может привести к повторяющемуся коллапсу/открытию альвеол, влияющее на эпителий мелких дыхательных путей, повреждение мембраны,(45) слущивание и некроз эпителия.(46)
Клиренс альвеолярной жидкости существенен для поддержания внутриальвеолярного жидкостного гомеостаза, который обычно нарушается при ВИЛП. В то время как вентиляция высокими объемами напрямую снижает Na/K-аденозин трифосфатную активность,(47) вентиляция малыми объемами может косвенно ухудшить клиренс жидкости из-за вызванной коллапсом альвеол гипоксии.(48)
Ухудшение барьерной функции эндотелия и эпителия, как и клиренса жидкости, ведет к развитию интерстициального и альвеолярного отека, который впоследствии вызывает дисфункцию сурфактанта, и нарушает эластичность легких.(49) Дисфункция сурфактанта делает легкие восприимчивыми к коллапсу альвеол, что ухудшает легочную механику.(50)
Хотя большинство доказательств грубых нарушений структур эндотелия и эпителия, вызванных механической вентиляцией, взяты из исследований in vitro на культуре клеток или in vivo на модели острого легочного повреждения,(51) вентиляция, применяемая к неповрежденным легким может влиять на альвеолярно-капиллярный барьер, особенно в присутствии независимого триггера воспаления, делающего механическую вентиляцию мощным ударом в присутствии системного воспаления.(29)
Из-за нарушения целостности альвеолярно-капиллярного барьера, и последовательной системной транслокации патогенов или медиаторов воспаления, ВИПЛ может привести к системному воспалительному ответу, влияющему уже не только на легкие, но и на весь организм.(52)
Неоднородность легких, например из-за ателектазов, делает большой вклад в развитие ВИПЛ. Однако, большинство экспериментальных доказательств получены из модели острого повреждения легких. Хотя их базовые патогенетические механизмы схожи, величина и время формирования ателектазов при остром повреждении легких может сильно отличаться от ателектазов, происходящих во время анестезии при относительно кратковременной интраоперационной механической вентиляции. Резорбция альвеолярного газа(53, 54) и компрессия легочных структур(55-58) может привести к ателектазу во время кратковременной механической вентиляции в неповрежденных легких.
В экспериментальной модели пневмонии на свиньях и экзогенный сурфактант и вентиляция, соответствующая подходу открытых легких, ослабляет бактериальный рост и системную транслокацию, минимизируя альвеолярный коллапс и формирование ателектазов.(59) В подобной модели пневмонии у свиней на ИВЛ транслокация была меньше с индивидуально подобранным PEEP, в то время как высокий и низкий уровни ПДКВ увеличивали бактериальную транслокацию.(60)
В изолированных неперфузируемых мышиных легких и «открытые легкие» («open lung approach») (дыхательный объем 6 мл/кг, рекрутмент-манёвры и ПДКВ от 14 до 16 смH2O), и «стратегия отдыха» (lung rest strategy) (ДО=6 мл/кг, ПДКВ 8-10 смH2O без рекрутментов) были ассоциированы со снижением легочного воспалительного ответа и улучшением респираторной механики, по сравнению с повреждающей механической вентиляцией (ДО=20 мл/кг и ПДКВ 0 смH2O). Интересно, что «lung rest strategy» была ассоциирована с меньшим уровнем апоптоза, но с большими ультраструктурными клеточными повреждениями, вероятнее всего из-за активации митоген-активируемого протеиназного пути, по сравнению со стратегией открытых легких.(61)
У здоровых мышей вентиляция с ДО 8 мл/кг и ПДКВ 4 смH2O вызывала обратимое повышение уровня цитокинов равно как и приток лейкоцитов, но легочная ткань была не повреждена.(62) В других исследованиях даже минимально-повреждающая вентиляция у мышей была способна вызвать ВИПЛ в отсутствии предшествующей агрессии в отношении легких.(63) Стоит отметить, что повреждающий эффект механической вентиляции на неповрежденные легкие частично зависит от продолжительности воздействия.(64) Однако, экспериментальное исследование продемонстрировало, что большие дыхательные объемы имеют только небольшое, если вообще какое-то, влияние на легкие, несмотря на продолжительность вентиляции.(25) Возможно, это можно объяснить отсутствием предшествующей агрессии (хирургического вмешательства). По факту же системное воспаление может привести к повреждению легких посредством ИВЛ.(65)
Стратегия механической вентиляции, защищающая легкие во время хирургического вмешательства
Ателектазы и интраоперационная механическая вентиляция
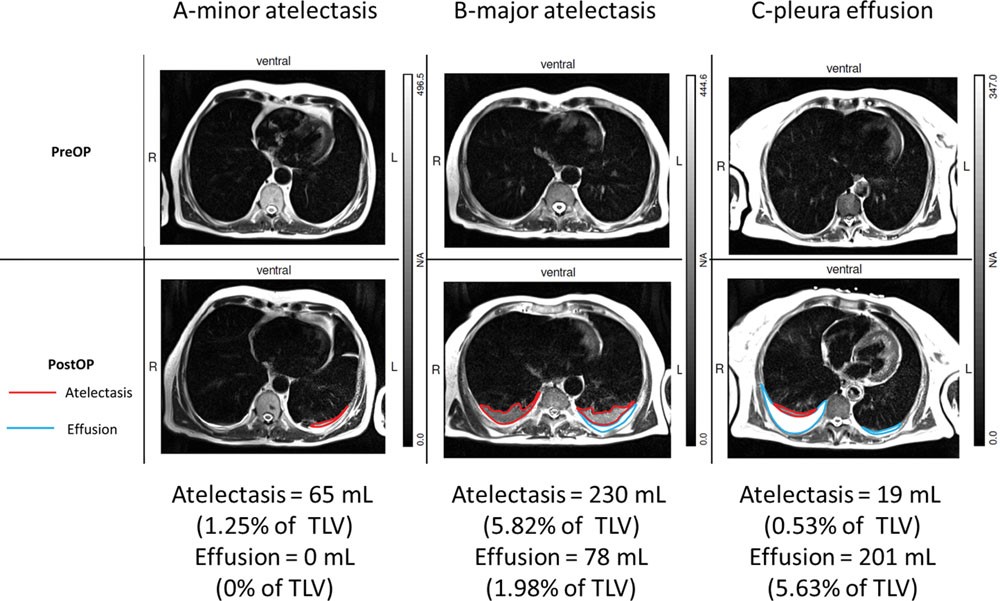
Ателектазы формируются более чем у 90% пациентов, подвергшихся общей анестезии(66) и могут в разной степени сохраняться и после операции, как показано на рисунке 2. Не вентилируемая область легких ближе к диафрагме варьирует в зависимости от операции и характеристик пациента, но было подсчитано, что она составляет от 3-6%(67-69) до 20-25%(66) и более, если рассчитывать на количество ткани.
Развитие ателектазов можно объяснить различными механизмами, включая(1) коллапс мелких дыхательных путей,(70-72) (2) компрессия легочных структур,(55-58) (3) абсорбция альвеолярного газа(53, 54) и (4) нарушение функции сурфактанта.(73) Дыхательный объем более 15 мл/кг на предсказанную массу тела приводил к увеличению объема легких в конце выхода (end-expiratory lung volume EELV) и противодействовало ателектазам во время операции.(74) При условии отсутствия противопоказания ПДКВ и рекрутмент манёвры могут так же делать вклад в предотвращение схлопывания мелких дыхательных путей во время анестезии.
Дыхательные объемы для интраоперационной протективной вентиляции
Движимые клиническими и экспериментальными исследованиями, дыхательные объемы во время ИВЛ были существенно уменьшены у пациентов с респираторным дистресс-синдромом (ОРДС).(75) Под влиянием этой практики в ОРИТ, схожая тенденция была отмечена и в операционных. Как сообщают различные исследования(76, 77) ДО в диапазоне 6-9 мл/кг предсказанной массы тела (predicted body weight) получили широкое признание при неповрежденных легких, несмотря на экспериментальные(25, 78) и клинические(79-81) данные, сообщающие что высокие значения не ассоциированы с легочным повреждением или воспалительным ответом. Более того, анестезиологи последовательно снизили ДО и во время однолегочной вентиляции. В то время как такие высокие объемы как 10 мл/кг использовались в прошлом, экспериментальные,(82, 83) и клинические(84-87) исследования показали, что ДО приблизительно 4-5 мл/кг вероятно больше подходит для протективной вентиляции, притом обеспечивая адекватный газообмен. Более того, небольшие РКИ показали, что ателектазы существенно не увеличиваются при низком ДО без ПДКВ от начала индукции анестезии, до конца операции.(67) Это так же подтверждается тем фактом, что механическая вентиляция с низкими объемами и низкими ПДКВ не приводит к прогрессирующему снижению комплаенса респираторной системы и газообмена во время открытых абдоминальных вмешательств в больших РКИ.(88) Следует иметь ввиду, что установленный и доставляемый ДО может существенно отличаться,(89) и что настройки должны регулироваться рассудительно.
ПДКВ для интраоперационной протективной вентиляции
Клинические исследования показали, что ПДКВ 10 смH2O требуется, чтобы уменьшить или устранить ателектазы,(69, 90, 91) улучшить комплаенс без увеличения мертвого пространства,(92, 93) поддержать EELV во время анестезии и у полных и у худых пациентов.(94) Другие исследования у нормальных субъектов показали, что ПДКВ 10 смН2О повышало объем легких, но не улучшало респираторную функцию по сравнению с ПДКВ 0 смН2О.(56) Безусловно, уровень ПДКВ должен быть выбран в соответствии со спецификой пациента, хирургического вмешательства, и положения пациента. Было предложено несколько целей для более индивидуального титрования ПДКВ, включая следующие: (1) оксигенация,(95) так же в сочетании с мертвым пространством(92) и EELV,(93) (2) механические свойства дыхательной системы,(96) и (3) распределение вентиляции при использовании томографии (electric impedance tomography).(97, 98) Однако, ничто из этого не показало улучшения исходов для пациента.
Хоть и спорный, но существует и альтернативный подход к ПДКВ во время анестезии, он называется «интраоперационные разрешенные ателектазы» (intraoperative permissive atelectasis), когда ПДКВ поддерживается на относительно низком уровне и отсутствуют рекрутмент-маневры. Концепция преследует цель уменьшить статическое напряжение в легких, которое тесно связано со средним давлением в дыхательных путях, предполагая, что спавшаяся легочная ткань защищена от механических повреждений (рисунок 3).
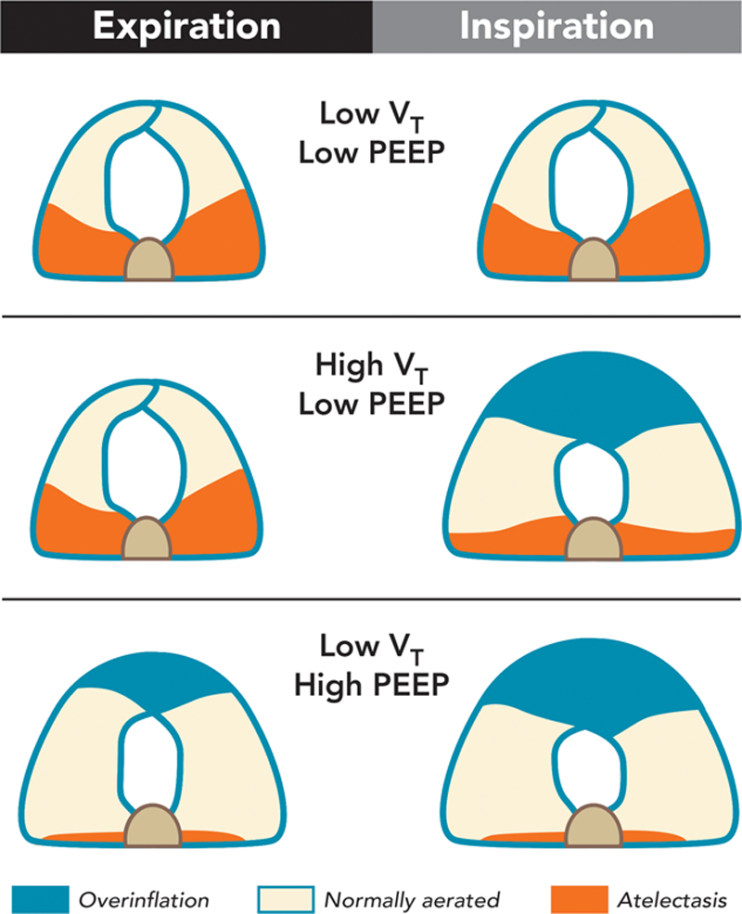
Эффект высоких и низких дыхательных объемов (VT) в конце вдоха и в конце выдоха с низким или высоким ПДКВ (PEEP) во время общей анестезии.
Ателектазы (красные), перераздутые области легких (синие), нормально вентилируемые регионы (белые). Во время вентиляции с низким VT и низким ПДКВ видим большое количество ателектазов в обе фазы дыхания с минимальной областью перерастяжения; при вентиляции с высоким VT и низким ПДКВ область ателектазов меньше, но увеличены участки перерастяжения в конце вдоха. Более того, имеет место большая область повторяющегося коллапса/раскрытия альвеол. Во время вентиляции низкими VT с высоким ПДКВ ателектазов меньше. Однако обширная область перераздувания наблюдается в конце обеих фаз дахыния, с минимальной областью коллапса/открытия во время дыхательных циклов.
Подход интраоперационных пермиссивных ателектазов ограничен ухудшением оксигенации, так как может потребоваться более высокая фракция кислорода во вдыхаемом воздухе. Теоретически интраоперационное низкое ПДКВ могло бы увеличить частоту возникновения и количество ателектазов даже в послеоперационном периоде, приводя в результате к ПОЛО. Недавнее большое ретроспективное исследование изучало связь между интраоперационными настойками ИВЛ и исходами; предположили, что использование минимального ПДКВ (2,2-5 смН2О) в сочетании с низким дыхательным объемом (6-8 мл/кг) ассоциировано с повышением риска 30-дневной летальности.(79) Однако, большое международное мультицентровое рандомизированное контролируемое исследование подвергло сомнению вывод о вреде «минимального» ПДКВ в сочетании с низким дыхательным объемом.(88) Так же у пожилых пациентов, подвергшихся большим абоминальным открытым хирургическим вмешательствам, стратегия сочетания низкого ДО, ПДКВ 12 смН2О и рекрутмент-манёвров повышало РаО2 интраоперационно, по сравнению со стратегией высокого ДО без ПДКВ, но этот эффект не распространялся на послеоперационный период.(100) Даже без рекрутмент-маневров, ПДКВ увеличивает оксигенацию во время «высоких» абдоминальных оперативных вмешательств, по сравнению с ПДКВ 0 смН2О, но опять же, этот эффект был ограничен интраоперационным периодом и не предотвращал постоперационные осложнения.(101)
Легочные рекрутмент-маневры для интраоперационной протективной вентиляции
ПДКВ наиболее эффективно в сохранении респираторный функции после предшествующего рекрутмента, который должен преодолеть давление открытия (до 40 смН2О у худых(102) и 40-50 смН2О у полных пациентов(103)), в отсутствии повреждения легких. Рекрутмент манёвр может быть представлен в различных вариациях, как показано на рисунке 4. Наиболее часто такие маневры представлены в качестве «bug squeezing», т.е. с использованием клапана ограничения давления (рисунок 4А). Однако, рекрутмент лучше контролируется если представлен, например, ступенчатым повышением ПДКВ, ДО или их обоих (рисунок 4B). При условии, что нет противопоказаний, давление плато на вдохе равное 40 смН2О наиболее приемлемо для полного рекрутмента.(104)
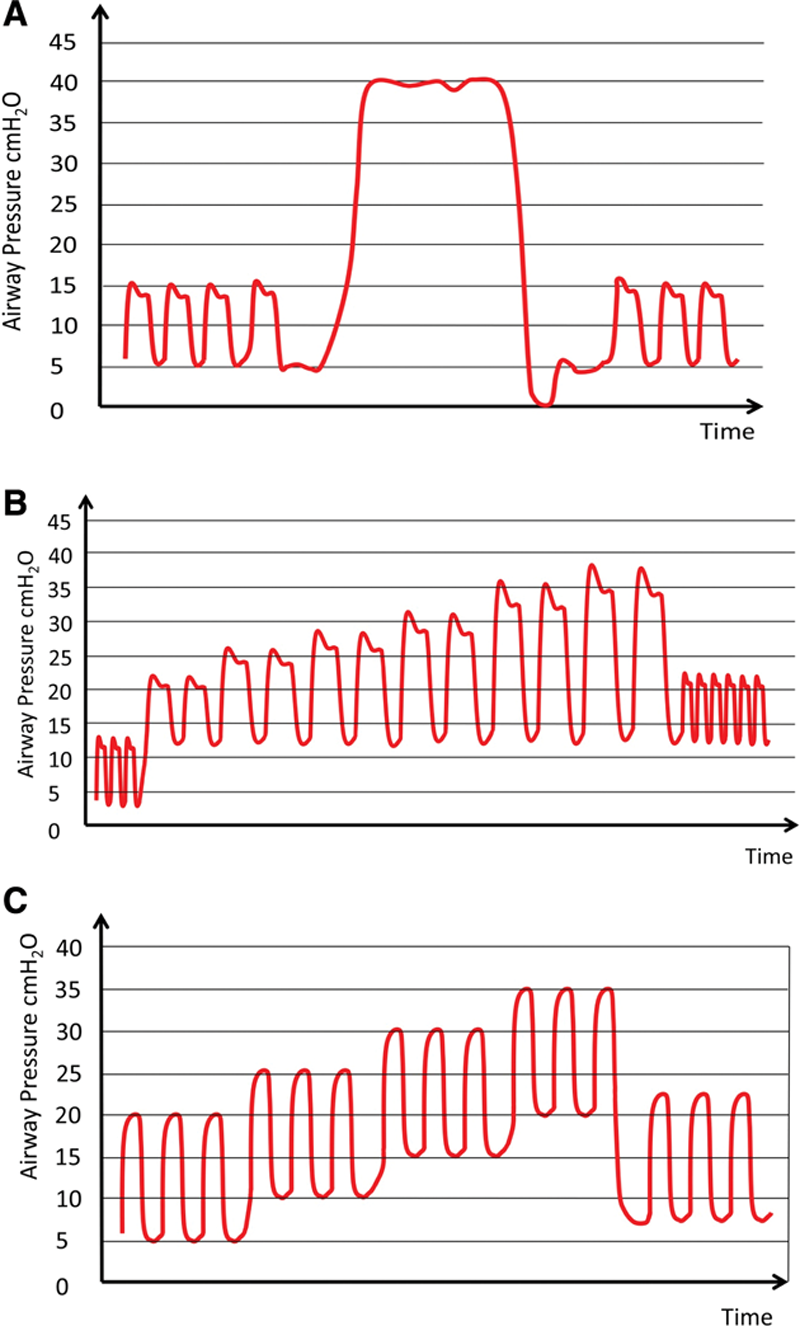
Изображение колебаний давления в дыхательных путях во время трех типов рекрутмент-маневров (красная линия).
(A) «Bag squeezing» использует клапан ограничения давления. Трудно контролировать давления в дыхательных путях, с риском баротравмы. (B) Ступенчатое повышение ДО во время volume-controlled ventilation. ПДКВ установлено на 12 смН2О, частота дыхания 6-8/мин, ДО повышается с 8мл/кг с шагом в 4мл/кг до достижения целевого давления открытия (30-40 смН2О). После 3-5 вдохов на этом давлении ПДКВ держат на 12 смН2О, ДО снижают до 6-8 мл/кг, частоту дыхания устанавливают до достижения нормокапнии. (C) Ступенчатое повышение ПДКВ на постоянном давлении вдоха 15-20 смН2О при pressure-controlled ventilation. ПДКВ увеличивают с шагом в 5 смН2О (30-60 секунд на один шаг) вплоть до 20 смН2О. После 3-5 вдохов ДО и ПДКВ доводят до желаемых уровней.
Наркозные аппараты, позволяющие использовать PCV, рекрутмент может быть проведен постоянным повышением давления от 15 до 20 смН2О и повышением ПДКВ до 20 смН2О с шагом в 5 смН2О (30-60 с на 1 шаг). После 3-5 вдохов на таком ПДКВ, что позволяет достичь целевое давление на вдохе, ПДКВ и ДО доводят до приемлемого (рисунок 4С).
Последние данные в пользу интраоперационной протективной вентиляции
Рандомизированные контролируемые исследования (РКИ), использовавшие неклинические первичные исходы
В литературе имеется 11 РКИ, которые сравнивали протективную вентиляцию с непротективной стратегией во время общей анестезии с оценкой неклинических исходов у пациентов с торакальным,(80, 84, 85, 105, 106) кардиохирургическим,(95, 107, 108) абдоминальным,(80, 100, 109) и спиномозговым вмешательством,(110) как показано в таблице 3. В восьми РКИ протективная вентиляция состояла и из низкого ДО и из высокого ПДКВ;(80, 85, 100, 105, 107-110) в двух РКИ состояла или из низкого ДО,(84) или высокого ПДКВ.(95) В одном исследовании были использованы рекрутмент-манёвры.(106)
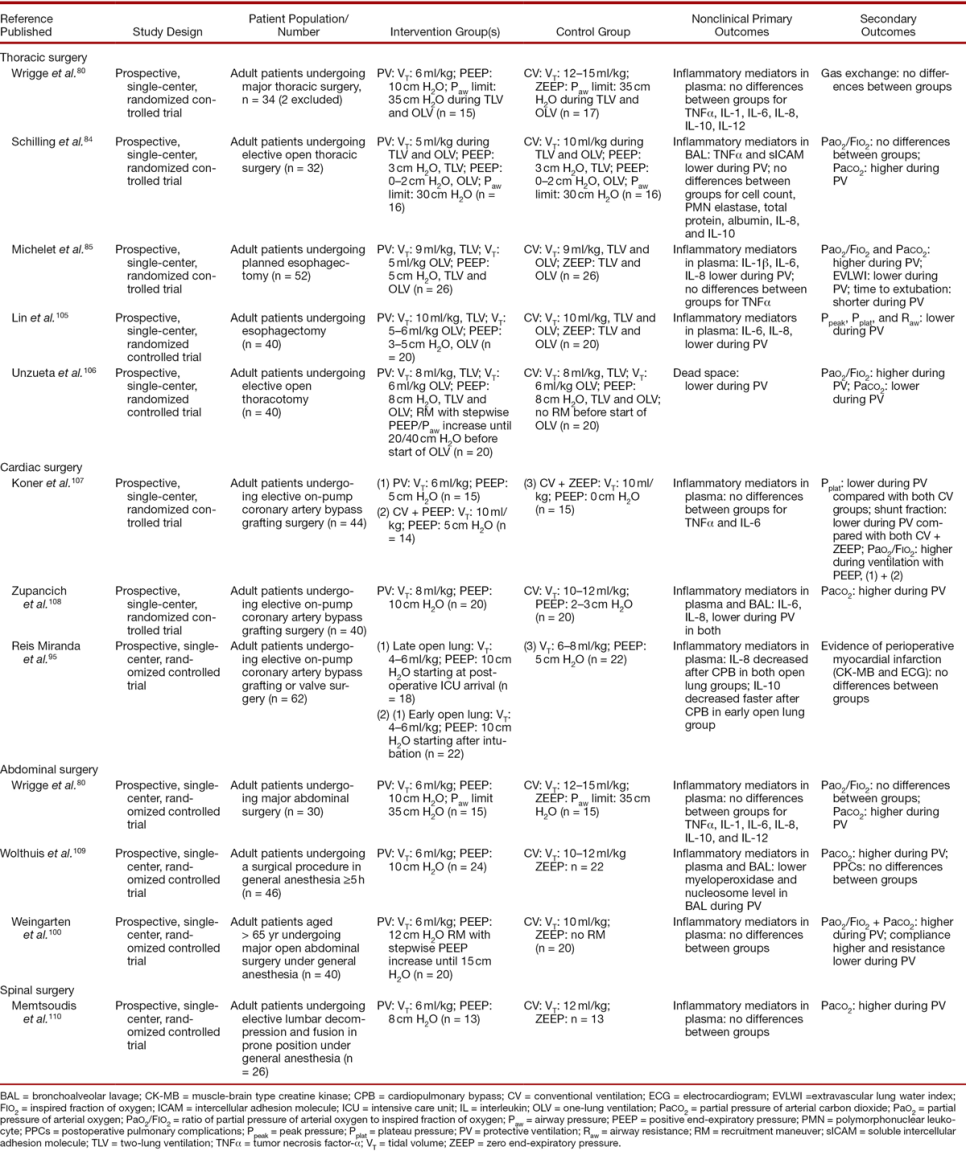
Рандомизированные контролируемые исследования, использовавшие неклинические первичные исходы.
Воздействие на воспалительный ответ несколько противоречиво. Хотя 4 РКИ показали отсутствие разницы в локальном уровне воспалительных медиаторов между пациентами протективной и непротективной вентиляции,(80, 100, 107, 110) 6 РКИ(84, 85, 95, 105, 108, 109) показали, что протективная стратегия была ассоциирована с более низкими уровнями медиаторов воспаления.
РКИ, использовавшие клинические первичные исходы
Было найдено восемь РКИ, сравнивавших протективную стратегию вентиляции с непротективной, с оценкой клинических первичных исходов у пациентов, подвергшихся плановому хирургическому,(88, 111-113) торакальному,(87, 114) кардиохирургическому,(115) и спинномозговому вмешательству,(116) как показано в таблице 4. В четырех РКИ протективная вентиляция состояла из низкого ДО и высокого ПДКВ,(112-114, 116) в четырех оставшихся РКИ она состояла либо из низкого ДО,(87, 111, 115) либо из высокого уровня ПДКВ.(88)
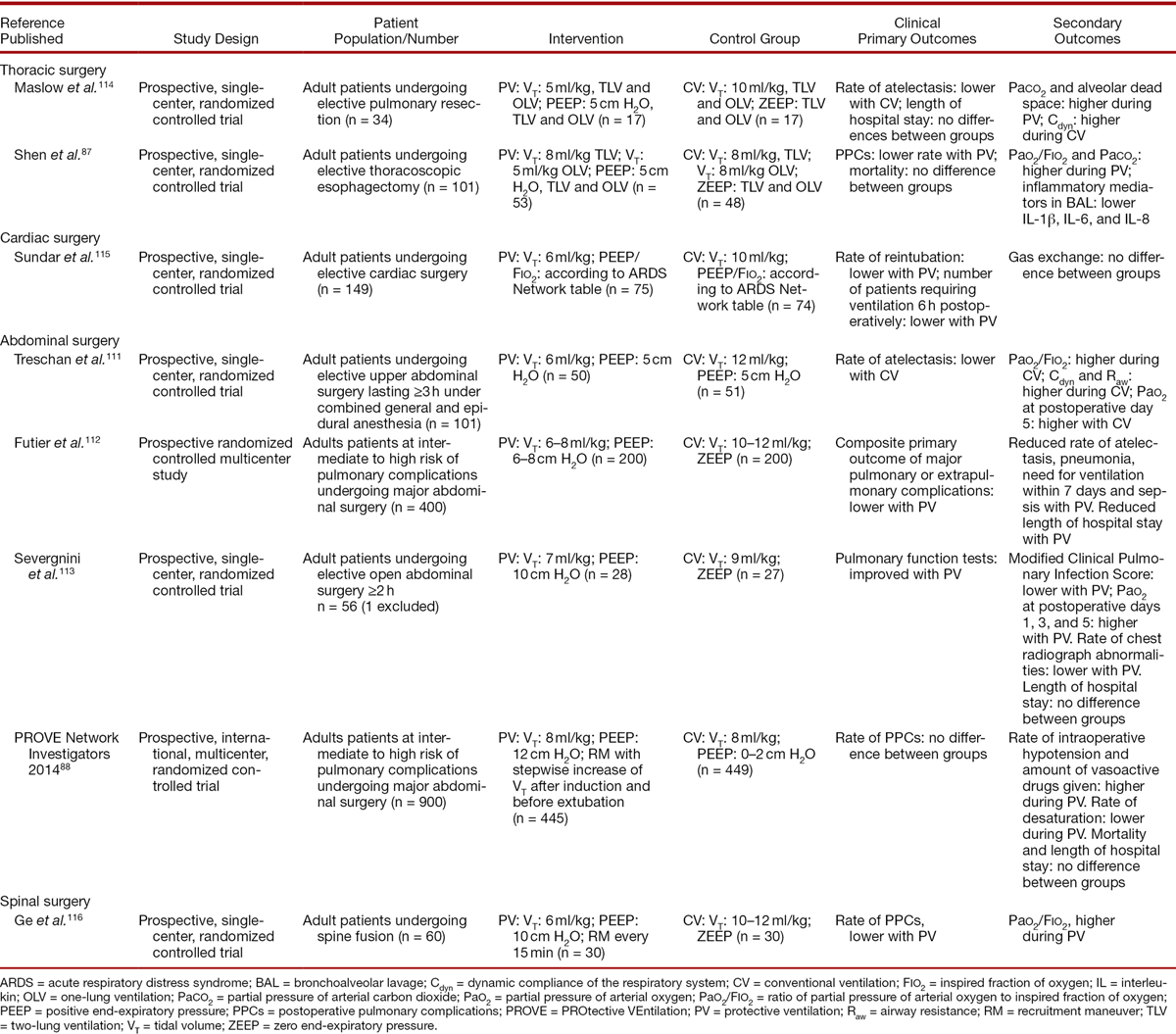
РКИ, использовавшие клинические первичные исходы.
Четыре исследования изучали ПОЛО в первые послеоперационные дни, включая бронхит, гипоксемию, ателектазы,(116) пневмонию, необходимость в инвазивной или неинвазивной вентиляции при остром повреждении легких,(112) модифицированную «Клиническую шкалу легочной инфекции», рентгенографию грудной клетки,(113) и гипоксемию, бронхоспазм, предполагаемую легочную инфекцию, легочный инфильтрат, аспирационный пневмонит, развитие ОРДС, ателектазов, плеврального выпота, отека легких и пневмоторакса.(88)
В Китайском одноцентровом РКИ(116) исследователи сравнили протективную вентиляцию (ДО 6 мл/кг и 10 смН2О) и непротективную (ДО 10-12 мл/кг и ПДКВ 0 смН2О) у 60-летних пациентов с классом II и III по ASA со спинномозговым вмешательством. У пациентов из группы протективной вентиляции уровень ПОЛО был ниже.
Во французком мультицентровом исследовании (Intraoperative PROtective VEntilation)(112) вентиляция с ДО 6-8 мл/кг и ПДКВ 6-8 смН2О сравнили с непротективной вентиляцией (ДО 10-12 мл/кг и ПДКВ 0 смН2О) у 400 худых пациентов с риском легочных осложнений от среднего до высокого после плановых операций. Первичные исходы (послеоперационные легочные и нелегочные осложнения) происходили менее часто у пациентов, получивших «протективную» вентиляцию. Такие осложнения были объяснены высвобождением медиаторов воспаления легкими в кровоток, что повлияло на легкие,(117) равно как и на другие органы.(52) Пациенты протективной вентиляции находились в стационаре меньшее количество дней, но летальность не менялась.
Итальянское одноцентровое исследование,(113) исследовало эффективность протективной вентиляции (ДО 7 мл/кг и ПДКВ 10 смН2О с рекрутмент-маневрами) против непротективной вентиляции (ДО 9 мл/кг и ПДКВ 0 см Н2О) у 56 пациентов, подвергшихся запланированным открытым абдоминальным операциям длительностью более 2 часов. Баллы по модифицированной клинической шкале оценки легочной инфекции были ниже у пациентов, получивших протективную вентиляцию. У этих пациентов так же было меньше патологических изменений на рентгенограмме грудной клетки, выше артериальная оксигенация, по сравнении с пациентами из группы непротективной вентиляции.
И, наконец, в международном мультицентровом исследовании, проведенном в Европе и США (PROtective Ventilation using High vs. Low PEEP [PROVHILO]),(88) исследователи the PROtective Ventilation Network сравнили ПДКВ 12 смН2О в сочетании с рекрутмент-маневрами против ПДКВ 2 смН2О без рекрутментов у 900 худых пациентов с высоким риском ПОЛО с плановыми открытыми хирургическими вмешательствами (ДО обеих групп 8 мл/кг). Частота возникновения ПОЛО не отличалась между пациентами, получившими протективную и непротективную вентиляцию.
Проблемы исследований, использующих совокупность вмешательств (bundles)
Как показано в предыдущих РКИ, использовавших не клинические и клинические первичные исходы, большинство РКИ относительно интраоперационной механической вентиляции сравнивали «пакеты» вмешательств (совокупность вмешательств, bundles), состоявшие из ДО и высокого ПДКВ, обычно сопровождавшихся рекрутментами.(112-114, 116) В частности рекрутмент-маневры отличались в разных исследованиях. В итальянском РКИ(113) исследователи использовали возрастающий подбор ДО до давления плато в 30 смН2О сразу после индукции анестезии, после любого отключения от вентилятора и непосредственно перед экстубацией, так же как и в PROVHILO.(88) В исследовании Intraoperative PROtective Ventilation(112) рекрутменты были представлены постоянным положительным давлением в 30 смН2О на 30 секунд каждые 30 минут, после интубации. Наконец, в Китайском одноцентровом РКИ(116) рекрутмент-маневры следовали похожему подходу, но давление плато было вплоть до 35 смН2О, и они проводились каждые 15 минут. И это сложно, если вообще возможно, сделать однозначное заключение, что приносит пользу, снижение дыхательного объема, повышение ПДКВ, или они оба? Сложно так же определить роль рекуртмент маневров. Более того, в какой степени был эффективен рекрутмент-маневр в открытии легких, не было изучено.
Результаты исследования the PROVHILO, однако, предполагают, что низкий ДО вероятнее, чем ПДКВ в сочетании с рекрутментами, отвечает за защиту легких в интраоперационный период. Эту мысль поддерживает так же анализ разных исследований на сравнение низких ДО,(87, 111, 115) высоких уровней ПДКВ,(88) их комбинаций,(112-114, 116) относительно развития ПОЛО (рисунок 5), а так же недавний мета-анализ индивидуальных данных пациентов.(131)
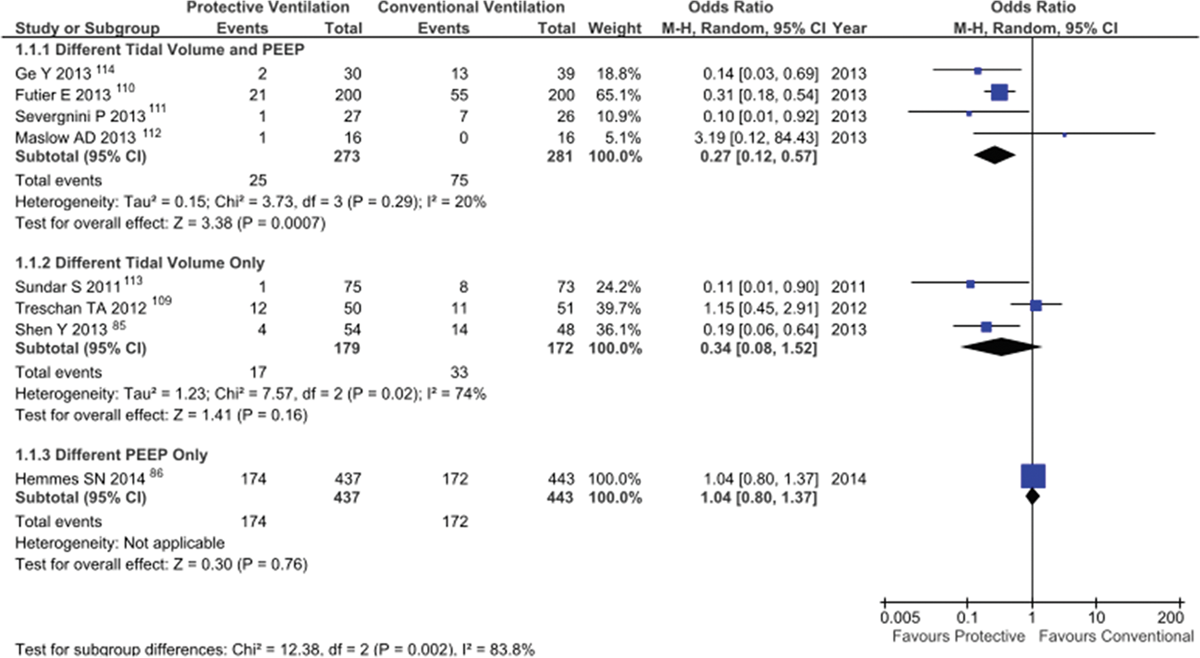
Риск послеоперационных легочных осложнений «протективной» против «непротективной» вентиляции в исследованиях, сравнивающих разные ДО,(87, 111, 115) разные ДО и ПДКВ,(112-114, 116) и разные уровни ПДКВ.(88) df = степень свободы; M-H = Mantel-Haenzel.
Безусловно, этот вывод справедлив только для исследуемой популяции, а значит для худых с риском ПОЛО, подвергшихся плановой абдоминальной хирургии. Другим группам пациентов, возможно, все же нужны высокие уровни ПДКВ и рекрутмент-маневры.
Проблемы составных показателей результатов
Составные результаты предлагают преимущество в увеличении частоты событий, что полезно для обеспечения достаточной статистической мощности исследования.(8) Логично комбинировать результаты которые раскрывают различные аспекты одного патологического процесса, такие как ПОЛО и ВИПЛ. Но есть два больших ограничения в отношении использования комбинированных результатов. Во-первых: компоненты комбинации могут существенно отличаться, с точки зрения частоты и тяжести. Во-вторых, разница в частоте переменных компонентов комбинированного результата может быть маскировано.
Недостатки протективной вентиляции
Термин «протективная» в контексте механической вентиляции подразумевает ослабление основных механизмов ВИПЛ (ателектотравма, волютравма, биотравма). Однако, стратегия, являющаяся протективной для легких, может так же приносить вред другим органам и системам. О потенциальном вреде протективной вентиляции сообщалось в исследовании PROVHILO,(88) в котором у пациентов, получивших вентиляцию с высоким ПДКВ и легочными рекрутмент-маневрами, интраоперационно гипотензия развивалась чаще и требовала больше вазоактивных препаратов. Эта находка соответствует – как минимум частично – находке французкого исследования, согласно которому протективная вентиляция ассоциировалась с большей частотой интраоперационной гипотензии.(112)
Стандарт помощи против изучаемых настроек: являются контрольные группы последних исследований репрезентативными относительно клинической практики?
В РКИ, посвященных протективной вентиляции, стратегия лечения контрольных групп может играть важную роль, когда делаются выводы для ежедневной практики общей анестезии. Мета-анализы говорят, что низкие дыхательные объемы являются протективными не только во время длительной вентиляции у пациентов в критическом состоянии,(118, 119) но так же и при краткосрочной вентиляции во время хирургического вмешательства.(119) Соответственно, анестезиологи обычно используют дыхательные объемы около 8-9 мл/кг, реже выше 10 мл/кг,(76) как показано на рисунке 6А. В противовес этому, дыхательные объемы, использованные для контрольных групп последних исследований были в районе от 9(113) до 12(112) мл/кг, за исключением PROVHILO(88) (рис. 6Б), где использовался ДО=7 мл/кг и в группе вмешательства и в контрольной группе. По аналогии и уровень ПДКВ в контрольных группах трех из четырех исследований(112, 113, 116) был ниже, чем принято в стандартах помощи на момент разработки этих исследований (рис. 6C и D). Вместе эти факты сообщают, что среди наиболее важных последних РКИ по протективной вентиляции только в PROVHILO контрольная группа получала лечение в соответствии с принятым на момент проведения исследования стандартом анестезиологической помощи. Соответственно, PROVHILO поднимает важный вопрос относительно механической вентиляции во время анестезии, а именно – действительно ли комбинация высокого ПДКВ и рекрутмент-манёвров обеспечивает защиту против ПОЛО? В этом исследовании высокий уровень ПДКВ не был индивидуализирован, но был основан на выводах из компьютерной томографии(69, 90, 91) и физиологических исследованиях.(92, 94)
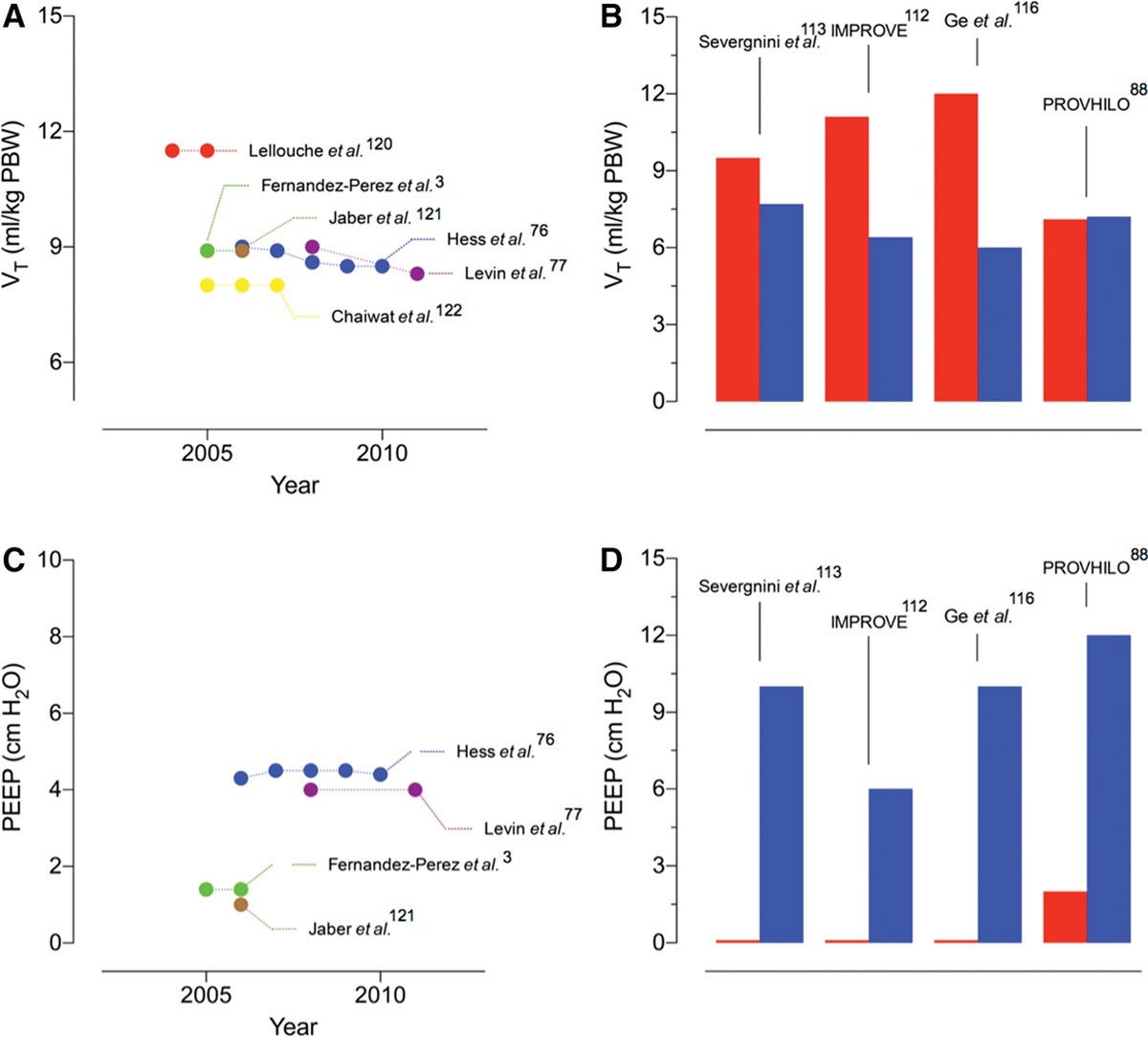
Установки ДО (VT) (A) и ПДКВ (C) согласно обсервационным исследованиям механической вентиляции в операционной (в Канаде,(120) Франции,(121) и США);(3, 76, 122) настройки VT (B) и ПДКВ (D) при непротективной (красный) и протективной (синий) вентиляции в четырех РКИ (Severgnini et al.,(123) Intraoperative PROtective VEntilation trials [IMPROVE],(112) Ge et al.,(116) и PROtective VEntilation using High vs. Low PEEP [PROVHILO]).(88) PWB = предсказанная масса тела.
Интраоперационная механическая вентиляция в соответствии с недавно полученными данными
Ряд обзоров и комментариев предполагает, что интраоперационная вентиляция в хирургии должна состоять из низких ДО (6-8 мл/кг), среднего уровня ПДКВ (6-8 смН2О), и периодичеких рекрутмент-маневров (каждые 30 минут).(5, 123-125) Однако, предыдущие обзоры и рекомендации были основаны на исследованиях, где изучалось влияние сразу нескольких мер, что не позволяет сделать вывод о роли отдельно каждого компонента. Более того, результаты самого крупного в этой области РКИ (PROVHILO) не могут быть взяты во внимание. Так же, рекомендации относительно использования ПДКВ во время анестезии, предположенные ранее,(124) не поддерживаются конечными результатами. В данный момент рекомендации, которые могут быть даны для клинической практики, суммированы в рисунке 7. У пациентов без избытка массы тела, без ОРДС,(126) подвергшихся открытой абдоминальной операции, механическая вентиляция должна быть представлена низким ДО (6-8 мл/кг) в сочетании с низким ПДКВ (≤ 2 смН2О), т.к. высокий уровень ПДКВ в сочетании с рекрутмент маневрами не дает дополнительной защиты против ПОЛО, но может ухудшать гемодинамику. Если развивается гипоксемия, и при условии, что другие причины исключены (гипотензия, гиповентиляция, ТЭЛА), FiO2 должен быть увеличен в первую очередь, с последующим увеличением ПДКВ, и рекрутментами, основанными на пошаговом увеличении ДО во время регулярной механической вентиляции, в соответствии с алгоритмом спасения описанном в исследовании PROVHILO,(88) и в отсутствии противопоказаний. У пациентов с ОРДС(126) подвергшихся открытым абдоминальным вмешательствам, интраоперационная вентиляция должна соответствовать the ARDS network protocol,(127) в соответствии с которыми более высокий ПДКВ(128) может быть полезен.(129)
Если целевые PaO2 (55-80 mmHg) и SpO2 (88-95%) не могут быть достигнуты, максимальный легочный рекрутмент с декрементным ПДКВ должен быть рассмотрен.(130)
Перспективы будущего
Несмотря на увеличение числа высококачественных РКИ по интраоперационной вентиляции, ряд вопросов остается нерешенным. Хотя мета-анализы строго уверены, что низкие ДО защищают против послеоперационныз легочных осложненный, нет ни одного РКИ, которому удалось бы доказать это утверждение. Потому что мета-анализы по этой теме часто включают исследования, изучавшие несколько вмешательств, например, низкие ДО и высокий ПДКВ с рекрутментами против высоких ДО без ПДКВ. Раздельная оценка их эффектов, например низких ДО или ПДКВ, подвержена критике. Следовательно, наиболее важны для клинической практики РКИ, изучающие мероприятия отдельно, и если контрольная группа получает помощь в соответствии с текущими стандартами оказания помощи.
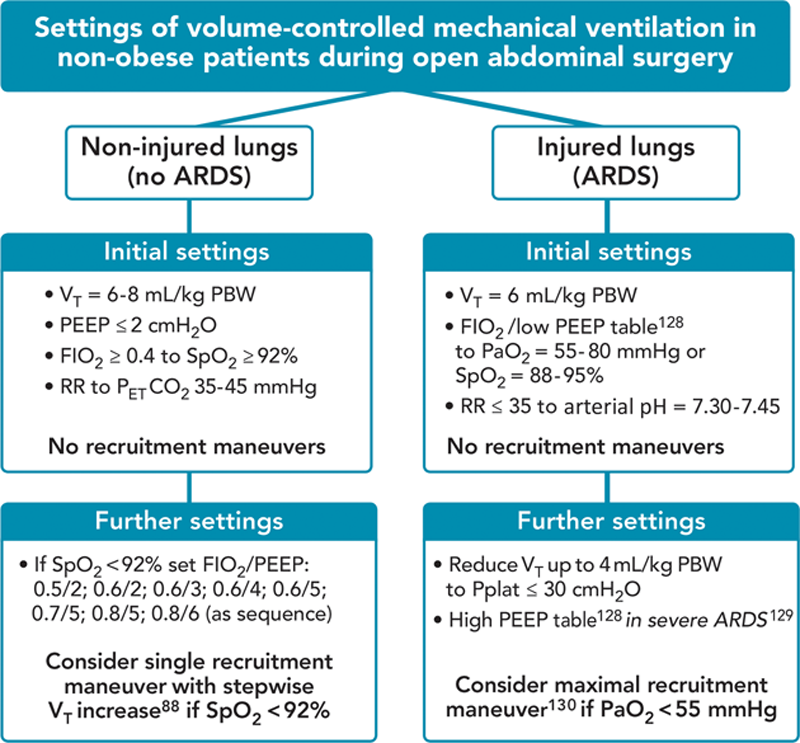
Предлагаемые параметры протективной ИВЛ у пациентов без ожирения во время открытой абдоминальной операции согласно концепции интраоперационных допустимых ателектазов.
ARDS = ОРДС, FiO2 = фракция кислорода во вдыхаемом воздухе, PaO2 = парциальное давление кислорода в артериальной крови, PWB = предсказанная масса тела, PEEP = ПДКВ, PETCO2 = давление CO2 в конце выдоха, Pplat = давление плато на вдохе, RR = частота дыхания, SpO2 = сатурация, VT = дыхательный объем.
Несмотря на убедительные доказательства того что ПДКВ и рекрутменты не обеспечивают дополнительной защиты и могут ухудшить гемодинамику, мы не знаем, будут ли полезны эти меры у пациентов с ожирением, или при однолегочной вентиляции. Так же мы не может исключать возможности того, что индивидуальный нацеленный на легочную функцию подбор ПДКВ может приводить к различным результатам. Более того, остается неясным как послеоперационный ателектаз – наиболее частое среди прочих ПОЛО – влияет на развитие легочной инфекции и тяжелого легочного повреждения и влияет ли на другие значимые исходы (длительность нахождения в стационаре и летальность). Вдобавок, дальнейшие исследования должны пролить свет на потенциальный вклад стратегии вентиляции не только во время индукции и поддержания анестезии, но и во время послеоперационного периода (например, неинвазивная вентиляция). Соответственно, потенциал периоперационных нелегочных мер (миорелаксация с использованием коротких препаратов, мониторингов и реверсией блока, ранней мобилизацией и респираторной терапией) в предотвращении ПОЛО должен быть так же исследован. Подобные исследования необходимы для поддержки будущих руководств для практики периоперационной механической вентиляции и дополнительных мер в широком спектре пациентов, и в хирургии, как открытой, так и лапароскопической.
Выводы
Перейти к оглавлению
Потенциал протективной вентиляции в снижении ПОЛО хорошо известен. РКИ показали, что низкие ДО, высокий ПДКВ, и рекрутмент-маневры могут защищать, но точная роль каждого отдельного из этих приемов ясна менее четко. Мета-анализы, взявшие все возможные последние клинические данные показывают, что использование низких ДО скорее всего более важная детерминанта для протективной вентиляции, чем ПДКВ, рекрутменты или их комбинация. У пациентов без ожирения и без ОРДС, подвергшихся открытому абдоминальному вмешательству, вентиляция должна быть представлена низкими ДО (6-8 мл/кг) в сочетании с низким уровнем ПДКВ, так как высокий уровень в сочетании с рекрутментами не дают дополнительной защиты против ПОЛО и могут нарушать гемодинамику. Если гипоксемия развилась и исключены другие причины (гипотензия, гиповентиляция, ТЭА), фракция кислорода должна быть увеличена в первую очередь, следом нужно увеличить ПДКВ и проводить рекрутменты, ступенчато повышая ДО. Необходимы дальнейшие исследования для руководства интраоперационной вентиляцией у широкого спектра пациентов с различными хирургическими вмешательствами.
Благодарности
Авторы признательны Anja Braune, M.Sc., и Loranzo Ball, M.D., из the Pulmonary Engineering Group, Department of Anesthesiology and Intensive Care Medisine, University Hospital Dresden, Technische Universitat Dresden, Dresden. Germany, за подсчет ателектазов и плеврального выпота на МРТ-сканах.
Конфликты интересов
Авторы заявляют об отсутствии конфликтов интересов.
Ссылки
- Canet J, Gallart L, Gomar C, Paluzie G, Vallès J, Castillo J, Sabaté S, Mazo V, Briones Z, Sanchis J; ARISCAT Group: Prediction of postoperative pulmonary complications in a population-based surgical cohort. Anesthesiology 2010; 113:1338–50
- Mazo V, Sabaté S, Canet J, Gallart L, Gama de Abreu M, Belda J, Langeron O, Hoeft A, Pelosi P: Prospective external validation of a predictive score for postoperative pulmonary complications. Anesthesiology 2014; 121:219–31
- Fernández-Pérez ER, Sprung J, Afessa B, Warner DO, Vachon CM, Schroeder DR, Brown DR, Hubmayr RD, Gajic O: Intraoperative ventilator settings and acute lung injury after elective surgery: A nested case control study. Thorax 2009;64:121–7
- Hemmes SN, Serpa Neto A, Schultz MJ: Intraoperative ventilator strategies to prevent postoperative pulmonary complications: A meta-analysis. Curr Opin Anaesthesiol 2013; 26:126–33
- Futier E, Constantin JM, Jaber S: Protective lung ventilation in operating room: A systematic review. Minerva Anestesiol 2014; 80:726–35
- Gajic O, Dabbagh O, Park PK, Adesanya A, Chang SY, Hou P, Anderson H III, Hoth JJ, Mikkelsen ME, Gentile NT, Gong MN, Talmor D, Bajwa E, Watkins TR, Festic E, Yilmaz M, Iscimen R, Kaufman DA, Esper AM, Sadikot R, Douglas I, Sevransky J, Malinchoc M; U.S. Critical Illness and Injury Trials Group: Lung Injury Prevention Study Investigators (USCIITG-LIPS): Early identification of patients at risk of acute lung injury: Evaluation of lung injury prediction score in a multicenter cohort study. Am J Respir Crit Care Med 2011; 183:462–70
- Canet J, Gallart L: Predicting postoperative pulmonary complications in the general population. Curr Opin Anaesthesiol 2013; 26:107–15
- Jammer I, Wickboldt N, Sander M, Smith A, Schultz MJ, Pelosi P, Leva B, Rhodes A, Hoeft A, Walder B, Chew MS, Pearse RM; European Society of Anaesthesiology (ESA) and the European Society of Intensive Care Medicine (ESICM): Standards for definitions and use of outcome measures for clinical effectiveness research in perioperative medicine: European Perioperative Clinical Outcome (EPCO) definitions: A statement from the ESA-ESICM joint taskforce on perioperative outcome measures. Eur J Anaesthesiol 2015; 32:88–105
- Arozullah AM, Daley J, Henderson WG, Khuri SF: Multifactorial risk index for predicting postoperative respiratory failure in men after major noncardiac surgery. The National Veterans Administration Surgical Quality Improvement Program. Ann Surg 2000; 232:242–53
- Arozullah AM, Khuri SF, Henderson WG, Daley J; Participants in the National Veterans Affairs Surgical Quality Improvement Program: Development and validation of a multifactorial risk index for predicting postoperative pneumonia after major noncardiac surgery. Ann Intern Med 2001; 135:847–57
- Canet J, Gallart L: Postoperative respiratory failure: Pathogenesis, prediction, and prevention. Curr Opin CritCare 2014; 20:56–62
- Sabaté S, Mazo V, Canet J: Predicting postoperative pulmonary complications: Implications for outcomes and costs. Curr Opin Anaesthesiol 2014; 27:201–9
- Smetana GW, Lawrence VA, Cornell JE; American College of Physicians: Preoperative pulmonary risk stratification for noncardiothoracic surgery: Systematic review for the American College of Physicians. Ann Intern Med 2006; 144:581–95
- Johnson RG, Arozullah AM, Neumayer L, Henderson WG, Hosokawa P, Khuri SF: Multivariable predictors of postoperative respiratory failure after general and vascular surgery: Results from the patient safety in surgery study. J Am Coll Surg 2007; 204:1188–98
- Brueckmann B, Villa-Uribe JL, Bateman BT, Grosse-Sundrup M, Hess DR, Schlett CL, Eikermann M: Development and validation of a score for prediction of postoperative respiratory complications. Anesthesiology 2013; 118:1276–85
- Kor DJ, Lingineni RK, Gajic O, Park PK, Blum JM, Hou PC, Hoth JJ, Anderson HL III, Bajwa EK, Bartz RR, Adesanya A, Festic E, Gong MN, Carter RE, Talmor DS: Predicting risk of postoperative lung injury in high-risk surgical patients: A multicenter cohort study. Anesthesiology 2014; 120:1168–81
- Trillo-Alvarez C, Cartin-Ceba R, Kor DJ, Kojicic M, Kashyap R, Thakur S, Thakur L, Herasevich V, Malinchoc M, Gajic O: Acute lung injury prediction score: Derivation and validation in a population-based sample. Eur Respir J 2011; 37:604–9
- Kor DJ, Warner DO, Alsara A, Fernández-Pérez ER, Malinchoc M, Kashyap R, Li G, Gajic O: Derivation and diagnostic accuracy of the surgical lung injury prediction model. Anesthesiology 2011; 115:117–28
- Higuita-Castro N, Mihai C, Hansford DJ, Ghadiali SN: Influence of airway wall compliance on epithelial cell injury and adhesion during interfacial flows. J Appl Physiol (1985) 2014; 117:1231–42
- Mead J, Takishima T, Leith D: Stress distribution in lungs: A model of pulmonary elasticity. J Appl Physiol 1970; 28:596–608
- Needham DM, Colantuoni E, Mendez-Tellez PA, Dinglas VD, Sevransky JE, Dennison Himmelfarb CR, Desai SV, Shanholtz C, Brower RG, Pronovost PJ: Lung protective mechanical ventilation and two year survival in patients with acute lung injury: Prospective cohort study. BMJ 2012; 344:e2124
- Hager DN, Krishnan JA, Hayden DL, Brower RG; ARDS Clinical Trials Network: Tidal volume reduction in patients with acute lung injury when plateau pressures are not high. Am J Respir Crit Care Med 2005; 172:1241–5
- Tremblay LN, Slutsky AS: Ventilator-induced lung injury: From the bench to the bedside. Intensive Care Med 2006; 32:24–33
- Chiumello D, Carlesso E, Cadringher P, Caironi P, Valenza F, Polli F, Tallarini F, Cozzi P, Cressoni M, Colombo A, Marini JJ, Gattinoni L: Lung stress and strain during mechanical ventilation for acute respiratory distress syndrome. Am J Respir Crit Care Med 2008; 178:346–55
- Protti A, Cressoni M, Santini A, Langer T, Mietto C, Febres D, Chierichetti M, Coppola S, Conte G, Gatti S, Leopardi O, Masson S, Lombardi L, Lazzerini M, Rampoldi E, Cadringher P, Gattinoni L: Lung stress and strain during mechanical ventilation: Any safe threshold? Am J Respir Crit Care Med 2011; 183:1354–62
- Spieth PM, Silva PL, Garcia CS, Ornellas DS, Samary CS, Moraes L, Bentes M, Morales MM, Kasper M, Güldner A, Huhle R, Koch T, Pelosi P, de Abreu MG, Rocco PR: Modulation of stress versus time product during mechanical ventilation influences inflammation as well as alveolar epithelial and endothelial response in rats. Anesthesiology 2015; 122:106–16
- Davidovich N, DiPaolo BC, Lawrence GG, Chhour P, Yehya N, Margulies SS: Cyclic stretch-induced oxidative stress increases pulmonary alveolar epithelial permeability. Am J Respir Cell Mol Biol 2013; 49:156–64
- Hussein O, Walters B, Stroetz R, Valencia P, McCall D, Hubmayr RD: Biophysical determinants of alveolar epithelial plasma membrane wounding associated with mechanical ventilation. Am J Physiol Lung Cell Mol Physiol 2013; 305:L478–84
- Suki B, Hubmayr R: Epithelial and endothelial damage induced by mechanical ventilation modes. Curr Opin Crit Care 2014; 20:17–24
- Moriondo A, Pelosi P, Passi A, Viola M, Marcozzi C, Severgnini P, Ottani V, Quaranta M, Negrini D: Proteoglycan fragmentation and respiratory mechanics in mechanically ventilated healthy rats. J Appl Physiol (1985) 2007; 103:747–56
- Moriondo A, Marcozzi C, Bianchin F, Passi A, Boschetti F, Lattanzio S, Severgnini P, Pelosi P, Negrini D: Impact of respiratory pattern on lung mechanics and interstitial proteoglycans in spontaneously breathing anaesthetized healthy rats. Acta Physiol (Oxf) 2011; 203:331–41
- Pelosi P, Rocco PR: Effects of mechanical ventilation on the extracellular matrix. Intensive Care Med 2008; 34:631–9
- Negrini D, Passi A, Moriondo A: The role of proteoglycans in pulmonary edema development. Intensive Care Med 2008; 34:610–8
- Moriondo A, Marcozzi C, Bianchin F, Reguzzoni M, Severgnini P, Protasoni M, Raspanti M, Passi A, Pelosi P, Negrini D: Impact of mechanical ventilation and fluid load on pulmonary glycosaminoglycans. Respir Physiol Neurobiol 2012; 181:308–20
- Spieth PM, Bluth T, Gama De Abreu M, Bacelis A, Goetz AE, Kiefmann R: Mechanotransduction in the lungs. Minerva Anestesiol 2014; 80:933–41
- Rocco PR, Dos Santos C, Pelosi P: Pathophysiology of ventilator-associated lung injury. Curr Opin Anaesthesiol 2012; 25:123–30
- Uhlig S: Ventilation-induced lung injury and mechanotransduction: Stretching it too far? Am J Physiol Lung Cell Mol Physiol 2002; 282:L892–6
- Parker JC, Hernandez LA, Longenecker GL, Peevy K, Johnson W: Lung edema caused by high peak inspiratory pressures in dogs. Role of increased microvascular filtration pressure and permeability. Am Rev Respir Dis 1990; 142:321–8
- West JB, Tsukimoto K, Mathieu-Costello O, Prediletto R: Stress failure in pulmonary capillaries. J Appl Physiol (1985) 1991; 70:1731–42
- Tinsley JH, De Lanerolle P, Wilson E, Ma W, Yuan SY: Myosin light chain kinase transference induces myosin light chain activation and endothelial hyperpermeability. Am J Physiol Cell Physiol 2000; 279:C1285–9
- Del Maschio A, Zanetti A, Corada M, Rival Y, Ruco L, Lampugnani MG, Dejana E: Polymorphonuclear leukocyte adhesion triggers the disorganization of endothelial cell-tocell adherens junctions. J Cell Biol 1996; 135:497–510
- Cavanaugh KJ Jr, Oswari J, Margulies SS: Role of stretch on tight junction structure in alveolar epithelial cells. Am J Respir Cell Mol Biol 2001; 25:584–91
- Egan EA: Lung inflation, lung solute permeability, and alveolar edema. J Appl Physiol Respir Environ Exerc Physiol 1982; 53:121–5
- Albert RK, Lakshminarayan S, Hildebrandt J, Kirk W, Butler J: Increased surface tension favors pulmonary edema formation in anesthetized dogs’ lungs. J Clin Invest 1979; 63:1015–8
- Pecchiari M, Monaco A, Koutsoukou A, D’Angelo E: Plasma membrane disruptions with different modes of injurious mechanical ventilation in normal rat lungs. Crit Care Med 2012; 40:869–75
- D’Angelo E, Koutsoukou A, Della Valle P, Gentile G, Pecchiari M: Cytokine release, small airway injury, and parenchymal damage during mechanical ventilation in normal open-chest rats. J Appl Physiol (1985) 2008; 104:41–9
- Lecuona E, Saldías F, Comellas A, Ridge K, Guerrero C, Sznajder JI: Ventilator-associated lung injury decreases lung ability to clear edema in rats. Am J Respir Crit Care Med 1999; 159:603–9
- Planès C, Escoubet B, Blot-Chabaud M, Friedlander G, Farman N, Clerici C: Hypoxia downregulates expression and activity of epithelial sodium channels in rat alveolar epithelial cells. Am J Respir Cell Mol Biol 1997; 17:508–18
- Bhattacharya J, Matthay MA: Regulation and repair of the alveolar-capillary barrier in acute lung injury. Annu Rev Physiol 2013; 75:593–615
- Rugonyi S, Biswas SC, Hall SB: The biophysical function of pulmonary surfactant. Respir Physiol Neurobiol 2008; 163:244–55
- Vlahakis NE, Hubmayr RD: Cellular stress failure in ventilatorinjured lungs. Am J Respir Crit Care Med 2005; 171:1328–42
- Imai Y, Parodo J, Kajikawa O, de Perrot M, Fischer S, Edwards V, Cutz E, Liu M, Keshavjee S, Martin TR, Marshall JC, Ranieri VM, Slutsky AS: Injurious mechanical ventilation and endorgan epithelial cell apoptosis and organ dysfunction in an experimental model of acute respiratory distress syndrome.JAMA 2003; 289:2104–12
- Rothen HU, Sporre B, Engberg G, Wegenius G, Högman M, Hedenstierna G: Influence of gas composition on recurrence of atelectasis after a reexpansion maneuver during general anesthesia. Anesthesiology 1995; 82:832–42
- Joyce CJ, Williams AB: Kinetics of absorption atelectasis during anesthesia: A mathematical model. J Appl Physiol (1985) 1999; 86:1116–25
- D’Angelo E: Factors affecting the distribution of transpulmonary pressure in animals and in man. Bull Eur Physiopathol Respir 1984; 20:415–22
- Pelosi P, Ravagnan I, Giurati G, Panigada M, Bottino N, Tredici S, Eccher G, Gattinoni L: Positive end-expiratory pressure improves respiratory function in obese but not in normal subjects during anesthesia and paralysis. Anesthesiology 1999; 91:1221–31
- Albert RK, Hubmayr RD: The prone position eliminates compression of the lungs by the heart. Am J Respir Crit Care Med 2000; 161:1660–5
- Pelosi P, Goldner M, McKibben A, Adams A, Eccher G, Caironi P, Losappio S, Gattinoni L, Marini JJ: Recruitment and derecruitment during acute respiratory failure: An experimental study. Am J Respir Crit Care Med 2001; 164:122–30
- van Kaam AH, Lachmann RA, Herting E, De Jaegere A, van Iwaarden F, Noorduyn LA, Kok JH, Haitsma JJ, Lachmann B: Reducing atelectasis attenuates bacterial growth and translocation in experimental pneumonia. Am J Respir Crit Care Med 2004; 169:1046–53
- Lachmann RA, van Kaam AH, Haitsma JJ, Lachmann B: High positive end-expiratory pressure levels promote bacterial translocation in experimental pneumonia. Intensive Care Med 2007; 33:1800–4
- Fanelli V, Mascia L, Puntorieri V, Assenzio B, Elia V, Fornaro G, Martin EL, Bosco M, Delsedime L, Fiore T, Grasso S, Ranieri VM: Pulmonary atelectasis during low stretch ventilation: “Open lung” versus “lung rest” strategy. Crit Care Med 2009; 37:1046–53
- Vaneker M, Halbertsma FJ, van Egmond J, Netea MG, Dijkman HB, Snijdelaar DG, Joosten LA, van der Hoeven JG, Scheffer GJ: Mechanical ventilation in healthy mice induces reversible pulmonary and systemic cytokine elevation with preserved alveolar integrity: An in vivo model using clinical relevant ventilation settings. Anesthesiology 2007; 107:419–26
- Wolthuis EK, Vlaar AP, Choi G, Roelofs JJ, Juffermans NP, Schultz MJ: Mechanical ventilation using non-injurious ventilation settings causes lung injury in the absence of preexisting lung injury in healthy mice. Crit Care 2009; 13:R1
- Hegeman MA, Hemmes SN, Kuipers MT, Bos LD, Jongsma G, Roelofs JJ, van der Sluijs KF, Juffermans NP, Vroom MB, Schultz MJ: The extent of ventilator-induced lung injury in mice partly depends on duration of mechanical ventilation. Crit Care Res Pract 2013; 2013:435236
- Wellman TJ, Winkler T, Costa EL, Musch G, Harris RS, Zheng H, Venegas JG, Vidal Melo MF: Effect of local tidal lung strain on inflammation in normal and lipopolysaccharide-exposed sheep. Crit Care Med 2014; 42:e491–500
- Lundquist H, Hedenstierna G, Strandberg A, Tokics L, Brismar B: CT-assessment of dependent lung densities in man during general anaesthesia. Acta Radiol 1995; 36:626–32
- Cai H, Gong H, Zhang L, Wang Y, Tian Y: Effect of low tidal volume ventilation on atelectasis in patients during general anesthesia: A computed tomographic scan. J Clin Anesth 2007; 19:125–9
- Rusca M, Proietti S, Schnyder P, Frascarolo P, Hedenstierna G, Spahn DR, Magnusson L: Prevention of atelectasis formation during induction of general anesthesia. Anesth Analg 2003; 97:1835–9
- Neumann P, Rothen HU, Berglund JE, Valtysson J, Magnusson A, Hedenstierna G: Positive end-expiratory pressure prevents atelectasis during general anaesthesia even in the presence of a high inspired oxygen concentration. Acta Anaesthesiol Scand 1999; 43:295–301
- Milic-Emili J, Torchio R, D’Angelo E: Closing volume: A reappraisal (1967–2007). Eur J Appl Physiol 2007; 99:567–83
- Juno J, Marsh HM, Knopp TJ, Rehder K: Closing capacity in awake and anesthetized-paralyzed man. J Appl Physiol Respir Environ Exerc Physiol 1978; 44:238–44
- Bergman NA, Tien YK: Contribution of the closure of pulmonary units to impaired oxygenation during anesthesia. Anesthesiology 1983; 59:395–401
- Stanley TH, Zikria BA, Sullivan SF: The surface tension of tracheobronchial secretions during general anesthesia. Anesthesiology 1972; 37:445–9
- Bendixen HH, Hedley-Whyte J, Laver MB: Impaired oxygenation in surgical patients during general anesthesia with controlled ventilation. A concept of atelectasis. N Engl J Med 1963; 269:991–6
- Esteban A, Frutos-Vivar F, Muriel A, Ferguson ND, Peñuelas O, Abraira V, Raymondos K, Rios F, Nin N, Apezteguía C, Violi DA, Thille AW, Brochard L, González M, Villagomez AJ, Hurtado J, Davies AR, Du B, Maggiore SM, Pelosi P, Soto L, Tomicic V, D’Empaire G, Matamis D, Abroug F, Moreno RP, Soares MA, Arabi Y, Sandi F, Jibaja M, Amin P, Koh Y, Kuiper MA, Bülow HH, Zeggwagh AA, Anzueto A: Evolution of mortality over time in patients receiving mechanical ventilation. Am J Respir Crit Care Med 2013; 188:220–30
- Hess DR, Kondili D, Burns E, Bittner EA, Schmidt UH: A 5-year observational study of lung-protective ventilation in the operating room: A single-center experience. J Crit Care 2013; 28:533.e9–15
- Levin MA, McCormick PJ, Lin HM, Hosseinian L, Fischer GW: Low intraoperative tidal volume ventilation with minimal PEEP is associated with increased mortality. Br J Anaesth 2014; 113:97–108
- Hong CM, Xu DZ, Lu Q, Cheng Y, Pisarenko V, Doucet D, Brown M, Aisner S, Zhang C, Deitch EA, Delphin E: Low tidal volume and high positive end-expiratory pressuremechanical ventilation results in increased inflammation and ventilator-associated lung injury in normal lungs. Anesth Analg 2010; 110:1652–60
- Wrigge H, Zinserling J, Stüber F, von Spiegel T, Hering R, Wetegrove S, Hoeft A, Putensen C: Effects of mechanical ventilation on release of cytokines into systemic circulation in patients with normal pulmonary function. Anesthesiology 2000; 93:1413–7
- Wrigge H, Uhlig U, Zinserling J, Behrends-Callsen E, Ottersbach G, Fischer M, Uhlig S, Putensen C: The effects of different ventilatory settings on pulmonary and systemic inflammatory responses during major surgery. Anesth Analg 2004; 98:775–81
- Wrigge H, Uhlig U, Baumgarten G, Menzenbach J, Zinserling J, Ernst M, Drömann D, Welz A, Uhlig S, Putensen C: Mechanical ventilation strategies and inflammatory responses to cardiac surgery: A prospective randomized clinical trial. Intensive Care Med 2005; 31:1379–87
- Gama de Abreu M, Heintz M, Heller AR, Sezchenyi RCM, Albrecht DM, Koch T: One-lung ventilation with high tidal volumes and zero positive end-expiratory pressure is injurious in the isolated rabbit lung model. Anesth Analg 2003; 96:220–8
- Kozian A, Schilling T, Schütze H, Senturk M, Hachenberg T, Hedenstierna G: Ventilatory protective strategies during thoracic surgery: Effects of alveolar recruitment maneuver and low-tidal volume ventilation on lung density distribution. Anesthesiology 2011; 114:1025–35
- Schilling T, Kozian A, Huth C, Bühling F, Kretzschmar M, Welte T, Hachenberg T: The pulmonary immune effects of mechanical ventilation in patients undergoing thoracic surgery. Anesth Analg 2005; 101:957–65
- Michelet P, D’Journo XB, Roch A, Doddoli C, Marin V, Papazian L, Decamps I, Bregeon F, Thomas P, Auffray JP: Protective ventilation influences systemic inflammation after esophagectomy: A randomized controlled study. Anesthesiology 2006; 105:911–9
- Licker M, Diaper J, Villiger Y, Spiliopoulos A, Licker V, Robert J, Tschopp JM: Impact of intraoperative lung-protective interventions in patients undergoing lung cancer surgery. Crit Care 2009; 13:R41
- Shen Y, Zhong M, Wu W, Wang H, Feng M, Tan L, Wang Q: The impact of tidal volume on pulmonary complications following minimally invasive esophagectomy: A randomized and controlled study. J Thorac Cardiovasc Surg 2013; 146:1267–73; discussion 1273–4
- Hemmes SN, Gama de Abreu M, Pelosi P, Schultz MJ: High versus low positive end-expiratory pressure during general anaesthesia for open abdominal surgery (PROVHILO trial): A multicentre randomised controlled trial. Lancet 2014; 384:495–503
- Scott DH, Drummond GB: III. Tidal volume measurement:OK for science, but too difficult for a workstation standard?Br J Anaesth 2013; 110:891–5
- Brismar B, Hedenstierna G, Lundquist H, Strandberg A, Svensson L, Tokics L: Pulmonary densities during anesthesia with muscular relaxation—A proposal of atelectasis. Anesthesiology 1985; 62:422–8
- Reinius H, Jonsson L, Gustafsson S, Sundbom M, Duvernoy O, Pelosi P, Hedenstierna G, Fredén F: Prevention of atelectasis in morbidly obese patients during general anesthesia and paralysis: A computerized tomography study. Anesthesiology 2009; 111:979–87
- Maisch S, Reissmann H, Fuellekrug B, Weismann D, Rutkowski T, Tusman G, Bohm SH: Compliance and dead space fraction indicate an optimal level of positive end-expiratory pressure after recruitment in anesthetized patients. Anesth Analg 2008; 106:175–81
- Satoh D, Kurosawa S, Kirino W, Wagatsuma T, Ejima Y, Yoshida A, Toyama H, Nagaya K: Impact of changes of positive end-expiratory pressure on functional residual capacity at low tidal volume ventilation during general anesthesia. J Anesth 2012; 26:664–9
- Futier E, Constantin JM, Petit A, Jung B, Kwiatkowski F, Duclos M, Jaber S, Bazin JE: Positive end-expiratory pressure improves end-expiratory lung volume but not oxygenation after induction of anaesthesia. Eur J Anaesthesiol 2010; 27:508–13
- Reis Miranda D, Gommers D, Struijs A, Dekker R, Mekel J, Feelders R, Lachmann B, Bogers AJ: Ventilation according to the open lung concept attenuates pulmonary inflammatory response in cardiac surgery. Eur J Cardiothorac Surg 2005; 28:889–95
- Cinnella G, Grasso S, Spadaro S, Rauseo M, Mirabella L, Salatto P, De Capraris A, Nappi L, Greco P, Dambrosio M: Effects of recruitment maneuver and positive end-expiratory pressure on respiratory mechanics and transpulmonary pressure during laparoscopic surgery. Anesthesiology 2013; 118:114–22
- Karsten J, Luepschen H, Grossherr M, Bruch HP, Leonhardt S, Gehring H, Meier T: Effect of PEEP on regional ventilation during laparoscopic surgery monitored by electrical impedance tomography. Acta Anaesthesiol Scand 2011; 55:878–86
- Zhao Z, Guttmann J, Möller K: Adaptive SLICE method: An enhanced method to determine nonlinear dynamic respiratory system mechanics. Physiol Meas 2012; 33:51–64
- Gattinoni L, Carlesso E, Caironi P: Stress and strain within the lung. Curr Opin Crit Care 2012; 18:42–7
- Weingarten TN, Whalen FX, Warner DO, Gajic O, Schears GJ, Snyder MR, Schroeder DR, Sprung J: Comparison of two ventilatory strategies in elderly patients undergoing major abdominal surgery. Br J Anaesth 2010; 104:16–22
- Wetterslev J, Hansen EG, Roikjaer O, Kanstrup IL, Heslet L: Optimizing peroperative compliance with PEEP during upper abdominal surgery: Effects on perioperative oxygenation and complications in patients without preoperative cardiopulmonary dysfunction. Eur J Anaesthesiol 2001; 18:358–65
- Rothen HU, Neumann P, Berglund JE, Valtysson J, Magnusson A, Hedenstierna G: Dynamics of re-expansion of atelectasis during general anaesthesia. Br J Anaesth 1999; 82:551–6
- Tusman G, Groisman I, Fiolo FE, Scandurra A, Arca JM, Krumrick G, Bohm SH, Sipmann FS: Noninvasive monitoring of lung recruitment maneuvers in morbidly obese patients: The role of pulse oximetry and volumetric capnography. Anesth Analg 2014; 118:137–44
- Rothen HU, Sporre B, Engberg G, Wegenius G, Hedenstierna G: Re-expansion of atelectasis during general anaesthesia: A computed tomography study. Br J Anaesth 1993; 71:788–95
- Lin WQ, Lu XY, Cao LH, Wen LL, Bai XH, Zhong ZJ: [Effects of the lung protective ventilatory strategy on proinflammatory cytokine release during one-lung ventilation]. Ai Zheng 2008; 27:870–3
- Unzueta C, Tusman G, Suarez-Sipmann F, Böhm S, Moral V: Alveolar recruitment improves ventilation during thoracic surgery: A randomized controlled trial. Br J Anaesth 2012; 108:517–24
- Koner O, Celebi S, Balci H, Cetin G, Karaoglu K, Cakar N: Effects of protective and conventional mechanical ventilation on pulmonary function and systemic cytokine release after cardiopulmonary bypass. Intensive Care Med 2004; 30:620–6
- Zupancich E, Paparella D, Turani F, Munch C, Rossi A, Massaccesi S, Ranieri VM: Mechanical ventilation affects inflammatory mediators in patients undergoing cardiopulmonary bypass for cardiac surgery: A randomized clinical trial. J Thorac Cardiovasc Surg 2005; 130:378–83
- Wolthuis EK, Choi G, Dessing MC, Bresser P, Lutter R, Dzoljic M, van der Poll T, Vroom MB, Hollmann M, Schultz MJ: Mechanical ventilation with lower tidal volumes and positive end-expiratory pressure prevents pulmonary inflammation in patients without preexisting lung injury. Anesthesiology 2008; 108:46–54
- Memtsoudis SG, Bombardieri AM, Ma Y, Girardi FP: The effect of low versus high tidal volume ventilation on inflammatory markers in healthy individuals undergoing posterior spine fusion in the prone position: A randomized controlled trial. J Clin Anesth 2012; 24:263–9
- Treschan TA, Kaisers W, Schaefer MS, Bastin B, Schmalz U, Wania V, Eisenberger CF, Saleh A, Weiss M, Schmitz A, Kienbaum P, Sessler DI, Pannen B, Beiderlinden M: Ventilation with low tidal volumes during upper abdominal surgery does not improve postoperative lung function. Br J Anaesth 2012; 109:263–71
- Futier E, Constantin JM, Paugam-Burtz C, Pascal J, Eurin M, Neuschwander A, Marret E, Beaussier M, Gutton C, Lefrant JY, Allaouchiche B, Verzilli D, Leone M, De Jong A, Bazin JE, Pereira B, Jaber S; IMPROVE Study Group: A trial of intraoperative low-tidal-volume ventilation in abdominal surgery. N Engl J Med 2013; 369:428–37
- Severgnini P, Selmo G, Lanza C, Chiesa A, Frigerio A, Bacuzzi A, Dionigi G, Novario R, Gregoretti C, Gama de Abreu M, Schultz MJ, Jaber S, Futier E, Chiaranda M, Pelosi P: Protective mechanical ventilation during general anesthesia for open abdominal surgery improves postoperative pulmonary function. Anesthesiology 2013; 118:1307–21
- Maslow AD, Stafford TS, Davignon KR, Ng T: A randomized comparison of different ventilator strategies during thoracotomy for pulmonary resection. J Thorac Cardiovasc Surg 2013; 146:38–44
- Sundar S, Novack V, Jervis K, Bender SP, Lerner A, Panzica P, Mahmood F, Malhotra A, Talmor D: Influence of low tidal volume ventilation on time to extubation in cardiac surgical patients. Anesthesiology 2011; 114:1102–10
- Ge Y, Yuan L, Jiang X, Wang X, Xu R, Ma W: [Effect of lung protection mechanical ventilation on respiratory function in the elderly undergoing spinal fusion]. Zhong Nan Da Xue Xue Bao Yi Xue Ban 2013; 38:81–5
- Bouadma L, Dreyfuss D, Ricard JD, Martet G, Saumon G: Mechanical ventilation and hemorrhagic shock-resuscitation interact to increase inflammatory cytokine release in rats. Crit Care Med 2007; 35:2601–6
- Putensen C, Theuerkauf N, Zinserling J, Wrigge H, Pelosi P: Meta-analysis: Ventilation strategies and outcomes of the acute respiratory distress syndrome and acute lung injury. Ann Intern Med 2009; 151:566–76
- Serpa Neto A, Cardoso SO, Manetta JA, Pereira VG, Espósito DC, Pasqualucci Mde O, Damasceno MC, Schultz MJ: Association between use of lung-protective ventilation with lower tidal volumes and clinical outcomes among patients without acute respiratory distress syndrome: A meta-analysis. JAMA 2012; 308:1651–9
- Lellouche F, Dionne S, Simard S, Bussières J, Dagenais F: High tidal volumes in mechanically ventilated patients increase organ dysfunction after cardiac surgery. Anesthesiology 2012; 116:1072–82
- Jaber S, Coisel Y, Chanques G, Futier E, Constantin JM, Michelet P, Beaussier M, Lefrant JY, Allaouchiche B, Capdevila X, Marret E: A multicentre observational study of intra-operative ventilatory management during general anaesthesia: Tidal volumes and relation to body weight. Anaesthesia 2012; 67:999–1008
- Chaiwat O, Vavilala MS, Philip S, Malakouti A, Neff MJ, Deem S, Treggiari MM, Wang J, Lang JD: Intraoperative adherence to a low tidal volume ventilation strategy in critically ill patients with preexisting acute lung injury. J Crit Care 2011; 26:144–51
- Goldenberg NM, Steinberg BE, Lee WL, Wijeysundera DN, Kavanagh BP: Lung-protective ventilation in the operating room: Time to implement? Anesthesiology 2014; 121:184–8
- Futier E, Marret E, Jaber S: Perioperative positive pressure ventilation: An integrated approach to improve pulmonary care. Anesthesiology 2014; 121:400–8
- Coppola S, Froio S, Chiumello D: Protective lung ventilation during general anesthesia: Is there any evidence? Crit Care 2014; 18:210
- Ranieri VM, Rubenfeld GD, Thompson BT, Ferguson ND, Caldwell E, Fan E, Camporota L, Slutsky AS: Acute respiratory distress syndrome: The Berlin Definition. JAMA 2012; 307:2526–33
- The Acute Respiratory Distress Syndrome Network: Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome. N Engl J Med 2000; 342:1301–8
- Brower RG, Lanken PN, MacIntyre N, Matthay MA, Morris A, Ancukiewicz M, Schoenfeld D, Thompson BT; National Heart, Lung, and Blood Institute ARDS Clinical Trials Network: Higher versus lower positive end-expiratory pressures in patients with the acute respiratory distress syndrome. N Engl J Med 2004; 351:327–36
- Briel M, Meade M, Mercat A, Brower RG, Talmor D, Walter SD, Slutsky AS, Pullenayegum E, Zhou Q, Cook D, Brochard L, Richard JC, Lamontagne F, Bhatnagar N, Stewart TE, Guyatt G: Higher vs lower positive end-expiratory pressure in patients with acute lung injury and acute respiratory distress syndrome: Systematic review and meta-analysis. JAMA 2010; 303:865–73
- Borges JB, Okamoto VN, Matos GF, Caramez MP, Arantes PR, Barros F, Souza CE, Victorino JA, Kacmarek RM, Barbas CS, Carvalho CR, Amato MB: Reversibility of lung collapse and hypoxemia in early acute respiratory distress syndrome. Am J Respir Crit Care Med 2006; 174:268–78
- Serpa Neto A, Hemmes SN, Barbas CS, Beiderlinden M, Biehl M, Binnekade JM, Canet J, Fernandez-Bustamante A, Futier E, Gajic O, Hedenstierna G, Hollmann MW, Jaber S, Kozian A, Licker M, Lin WQ, Maslow AD, Memtsoudis SG, Reis Miranda D, Moine P, Ng T, Putensen C, Ranieri M, Scavonetto F, Schilling T, Schmid W, Selmo G, Severgnini P, Sprung J, Sundar S, Talmor D, Treschan T, Unzueta C, Weingarten TN, Wolthuis EK, Wrigge H, Gama de Abreu M, Pelosi P, Schultz MJ, Sprung J: Protective versus conventional ventilation for surgery: A systematic review and individual patient data meta-analysis. Anesthesiology 2015 [Epub ahead of print]





