Anaesthesia 2017, 72
D. G. Nevin, Consultant
Department of Anaesthesia and London’s Air Ambulance, The Royal London Hospital Major Trauma Centre, Bart’s Health NHS Trust, London, UK. Email: daniel.nevin2@bartshealth.nhs.uk
K. Brohi, Professor
Centre for Trauma Sciences, The Blizard Institute, Queen Mary University of London, London, UK
Оригинал статьи
Перевод: Девятый вызов | t.me/ninthcall
Неконтролируемое кровотечение является ведущей причиной подавляющего большинства потенциально предотвратимых смертей после тяжелой травмы [1-3]. Недавнее исследование показало, что смертность у пациентов с травмой, требующих гемотрансфузии, составляет 50% [4]. Половина этих смертей происходит в первые 24 часа, в свою очередь, половина случаев досуточной летальности происходит в первые 3 часа после прибытия “скорой помощи” вследствие массивной кровопотери [1, 5-7]. Краеугольный камень реанимации пациентов с шоком – восстановление перфузии и элиминация задолженности по кислороду. Однако в последние годы стало очевидным, что пациентам с активным кровотечением невозможно восстановить перфузию и ликвидировать кислородную задолженность [8].
Попытки объемной реанимации таких пациентов не только не достигают этих целей, но и приводят к гемодилюции, коагулопатии, отеку тканей, дисфункции органов и смерти. Современные подходы к лечению этих пациентов переключили цели с восстановления перфузии на поддержание минимально достаточной гемодинамики. Эта парадигма получила название ‘damage control resuscitation’ и нацелена на ранний контроль кровотечения и сохранение коагуляции [8-11].
Допустимая гипотензия является центральной частью этого подхода к лечению пациентов с кровотечением [12, 13].
Допустимая гипотензия подразумевает достижение адекватных, а не нормальных цифр артериального давления. Этот подход используется у активно кровоточащих пациентов до гемостаза, после чего начинается окончательная объемная реанимация. Этот подход никоим образом не нарушает тот основной принцип, что восстановление системного кровотока и адекватная перфузия тканей у критических пациентов должны быть достигнуты как можно скорее. Однако, массивная инфузия в условиях непрерывной потери крови приводит к дилюционной коагулопатии и гипотермии, в то время как транзиторное повышение артериального давления способствует дальнейшему кровотечению [6, 7, 12, 14].
Большой объем инфузии может быть ассоциирован с дисфункцией органов, абдоминальным компартмент-синдромом и смертью у пациентов с шокогенной травмой [12-15]. Таким образом, допустимая гипотензия может способствовать созданию среды, которая оптимизирует коагуляцию, хотя и при потенциальном снижении перфузионного давления в тканях, пока хирургическое вмешательство не восстановит целостность сосудистого русла [9]. По сути, это может быть описано как потенциальный краткосрочный вред, но с целью достижения глобального итогового результата.
Каковы доказательства?
Существует большое количество экспериментальной литературы, которая поддерживает стратегию допустимой гипотензии [5]. Хотя реанимация без инфузии неуместна, так как это может привести к опасному снижению перфузионного давления, агрессивная объемная реанимация способствует
чрезмерной кровопотере вследствие смещения сформировавшихся тромбов и ассоциирована с увеличением смертности [8, 13, 16-18]. Графическое представление зависимости смертности и интенсивности кровотечения от артериального давления см. на Рис. 1 и 2. Это хорошо подтверждается результатами экспериментов на животных, хотя ограничения экстраполяции таких данных на людей нам хорошо известны [5].
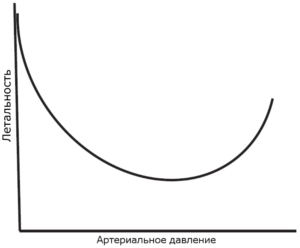
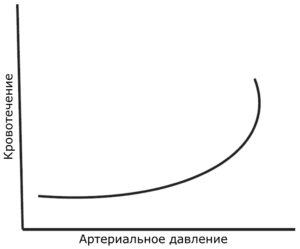
Клинические исследования с целью обоснования подхода допустимой гипотензии проводить непросто, и по понятным причинам они малочисленны.
Классическое исследование Бикелла на материале проникающих ранений туловища сравнивало рестриктивную и стандартную стратегию объемной реанимации на догоспитальном этапе. Положительное влияние на летальность и частоту осложнений выявлено при использовании рестриктивной стратегии [16]. В последующей работе Даттон сравнивал объёмную реанимацию при травме в стационарных условиях в двух группах: с целевыми значениями систолического давления 70 и 100 мм рт. В этом исследовании летальность была одинаковой в нормотензивной и гипотензивной группах. Ни польза, ни вред допустимой гипотензии не были продемонстрированы [12, 19].
Самый яркий результат обоих этих исследований заключался в том, что целевые значения артериального давления не могли быть достигнуты на продолжительное время, а в нормотензивных группах требования к объему инфузии были намного выше. Недавние исследования показали, что инфузионная терапия большими объемами связана с увеличением летальности, более высокой частотой гемотрансфузий и коагулопатии во взрослом и педиатрическом контингентах [6, 13, 15, 20]. Однако на сегодняшний день нет качественных проспективных исследований гипотензивной стратегии [13].
Данные догоспитального этапа аналогичны. Hussmann et al. ретроспективно рассмотрели 7600 пациентов и показали, что увеличение объема жидкости, вводимой догоспитально, было независимым фактором риска смерти (> 2 л догоспитального объема ОШ 2,7, 95% ДИ 1,6-4,5 против ≤ 500 мл) [6]. Другие данные показывают, что хотя догоспитальная инфузия была связана с уменьшением индекса шока при пониженных объемах (0,5-1,0 л), более высокие объемы (1-2 л) связаны со значительным увеличением частоты внутрибольничных гемотрансфузий (ОШ 3,3, 95% ДИ 2,0-5,3) [7]. Объемы более 2 л кристаллоидов были независимо связаны с почти 10-кратным увеличением количества последующих гемотрансфузий (ОШ 9,9, 95% ДИ 4,0-24,6) [7].
Ретроспективный обзор базы данных германского реестра травмы (17 200 пациентов с сочетанной и множественной травмой) показал возрастание частоты коагулопатии при увеличении объемов инфузии. Коагулопатия наблюдалась у более чем 40% пациентов, которые получили более 2 л жидкости; более 50% пациентов, которые получили более 3 литров жидкости; и у более 70% пациентов, получивших более 4 л жидкости. Некоторые исследователи даже пришли к выводу, что не следует более пропагандировать рутинное использование инфузии на догоспитальном этапе у всех пострадавших с травмой [21]. Однако такой чрезмерно упрощенный подход подвергается критике в связи с опасностью неудовлетворительной объемной реанимации при определенных сценариях [7].
В последние годы на основе данных, собранных в ходе вооруженных конфликтов, выполнено большое количество полевых исследований [10, 22]. Оказание помощи раненым бойцам фокусировалось на комплексе мероприятий «damage control resuscitation», включая допустимую гипотензию. Рекомендуется раннее применение этих принципов с особым акцентом на допустимой гипотензии [22-25].
Многие из этих принципов были внедрены в гражданскую практику оказания помощи при травме [9, 11, 13, 26]. Несмотря на региональные различия в подходах к реанимации, допустимая гипотензия фигурирует в качестве центрального постулата с некоторыми вариациями ее степени [27, 28]. Это привело к разительному сокращению выполненных гемотрансфузий по сравнению с прогнозируемыми их объемами, включая снижение потребности как в цельной крови, так и в ее продуктах в некоторых травмоцентрах [26].
Гражданские условия травматогенеза не предполагают сходства эпидемиологического профиля населения с таковым у молодых, исходно здоровых бойцов. Однако последний анализ Национального банка данных травмы в США выявил отсутствие синергетического эффекта возраста и сниженного допустимого артериального давления на летальность, несмотря на более высокий риск смерти у пожилых пострадавших по сравнению с молодыми. Исследователи пришли к выводу о допустимости гипотензивной стратегии даже у возрастных пациентов [29].
Клиническая практика
В поисках разумного баланса предлагались многочисленные подходы и консенсусы [5, 7]. В результате появились руководства, поддерживающие допустимую гипотензию [1, 5, 7, 15]. Европейское руководство по лечению массивных кровотечений и недавнее руководство Национального института усовершенствования здравоохранения (NICE) рекомендуют следующие подходы в лечении пациентов с продолжающимся кровотечением [1, 5]:
- Ограничение объемной реанимации вплоть до раннего окончательного контроля кровотечения.
- Титровать объем инфузии на догоспитальном этапе до получения пальпируемого центрального пульса.
- В стационаре акцент на скорейшем контроле кровотечения, титровать объемную реанимацию для поддержания центрального кровообращения.
Эти рекомендации нацелены на дозирование жидкостной реанимации, чтобы поддерживать систолическое артериальное давление на цифрах около 80 – 90 мм рт. ст., что грубо соответствует наличию пульса на магистральных артериях и удовлетворительному уровню высшей нервной деятельности. Такой результат достигается повторными малыми болюсами жидкости объемом 250 мл до появления пульса. Выбор такого единичного объема довольно произволен, хотя таких болюсов должно быть достаточно, чтобы повлиять на артериальное давление в условиях массивной кровопотери, системной вазоконстрикции и малого объема распределения. Требуются малые объемы инфузии, чтобы подтолкнуть гемодинамику пациента вверх по кривой Старлинга и улучшить сердечный выброс.
Вопрос о целевых значениях артериального давления не решен до сих пор. Мы можем лишь утверждать, что пострадавшим с травмой не наносят вреда непродолжительные периоды гипотензии [11, 13, 26, 29]. Существуют некоторые экспериментальные доказательства, что тканевые пороги ауторегуляции могут быть ниже, чем изначально предполагалось [30]. В исследовании, посвященном группе пациентов, нуждавшихся в интенсивной терапии, в том числе после травмы, регистрировали артериальное давление в момент острого ухудшения состояния и смерти. Систолическое давление в диапазоне 35-60 мм рт.ст. и диастолическое 20-35 мм рт.ст. пациенты переносили на пороге смерти [30]. Эти значения следует признать субминимальными, их нельзя допускать ни в коем случае. Чтобы обеспечить перфузионное давление в коронарных артериях, необходимо поддерживать артериальное давление в безопасных пределах, например, одно или два стандартных отклонения выше упомянутых уровней артериального давления [30].
Пациенты с тяжелыми травмами нуждаются в переливании продуктов крови с нормированным соотношением эритроцитарной массы, плазмы и тромбоцитов (например, 1: 1: 1) [31-33]. Тяжелое кровотечение у пациентов с травмой может привести к нарушениям свертываемости крови [34, 35]. До недавнего времени коагулопатия считалась поздним явлением, возникающим в основном из-за потери коагуляционных факторов при кровотечении и гемодилюции плазмозаменителями. Однако теперь признано, что острая травматическая коагулопатия встречается в течение нескольких минут после травмы примерно у 25% пациентов и связана с четырехкратным увеличением смертности [34]. Этот процесс является многофакторным, но, как полагают, частично обусловлен эндогенными явлениями, возникающими в результате повреждения тканей при тяжелом шоке, высвобождением тканевых факторов и распространенным воспалительным ответом [34-37].
Черепно-мозговая травма
Очевидной областью разногласий является оптимальная стратегия для лечения пациента с продолжающимся кровотечением и черепно-мозговой травмой (ЧМТ) [38]. Ретроспективные данные наблюдений для пациентов с ЧМТ свидетельствуют о том, что снижение среднего артериального давления связано с увеличением летальности [39, 40]. Недавнее руководство, опубликованное Фондом Brain Trauma Foundation, рекомендует поддержание систолического артериального давления выше 110 мм рт. ст. (уровень доказательности 3), но конкретно не указывают, применяется ли это при продолжающемся кровотечении [41]. В настоящее время существуют разногласия по поводу того, следует ли изменить руководящие принципы для допустимой гипотензии при наличии травмы головы,так как не проводились проспективные исследования на людях [38, 42].
В экспериментальных данных чрезмерно агрессивная жидкостная реанимация при сочетании ЧМТ и кровотечения вредит церебральной перфузии [43, 44]. Инфузия большего объема кристаллоидов для поддержания артериального давления приводит к увеличению экстравазации жидкости, повреждению микроциркуляции, отеку головного мозга и повышению внутричерепного давления, что нивелирует возможную пользу от повышения артериального давления [44-46]. В экспериментальной модели свиней с индуцированным кровотечением и одновременной ЧМТ все животные с агрессивной жидкостной реанимацией погибли. В группе реанимации с допустимой гипотензией выжившие (50%) смогли восстановить свой гемодинамический профиль и параметры церебральной оксиметрии до исходного уровня в результате реанимации [47].
И Европейское руководство, и гайдлайн NICE для пациента с сочетанными повреждениями (продолжающееся кровотечение и ЧМТ), рекомендуют следующее [1, 5-7]:
- При доминировании геморрагического шока продолжайте ограниченную объемную реанимацию.
- При доминировании симптоматики ЧМТ используйте менее ограниченную объемную реанимацию, чтобы поддерживать церебральное перфузионное давление.
Последний момент, который мы рассматриваем, – это переносимая продолжительность допустимой гипотензии. Особое внимание следует уделить ситуациям, в которых хирургическое лечение вынужденно отсрочено [10, 22-25]. Внедряются попытки так называемой «гибридной» реанимации, сочетающей элементы допустимой гипотензии и классической реанимации. Допустимая гипотензия «разрешена» до 60 минут, чтобы «стимулировать» образование тромбов; это может сыграть роль в смягчении коагулопатии, а также в снижении системного воспалительного ответа и цитокиновой нагрузки [24, 26]. После этого постепенно восстанавливают нормотензивный гемодинамический профиль для обеспечения микрососудистой перфузии и доставки кислорода в органы и ткани [14, 15]. На практике продолжительность разрешающей гипотензии должна быть как можно короче, и поэтому все усилия должны быть направлены на раннюю остановку кровотечения.
Пациент с продолжающимся кровотечением остается проблемой для противошоковой бригады. Перфузия тканей, лечение коагулопатии и ограничение кровотечения должны быть тщательно сбалансированы. Допустимая гипотензия, потенциально нежелательная с точки зрения физиологии, является средством для достижения глобальной цели. Хотя гипотензивная стратегия может еще потребовать тонкой настройки, она служит эффективным дополнением, которое почти наверняка способствовало наблюдаемому в последнее время улучшению исходов у пострадавших с тяжелым кровотечением.
ЛИТЕРАТУРА
- Rossaint R, Bouillon B, Cerny V, et al. The European guideline on management of major bleeding and coagulopathy following trauma; fourth edition. Critical Care 2016; 12: 100.
- World Health Organization. Cause-specific mortality and morbidity. 2009. http://www.who.int/whosis/whostat/ EN_WHS09_Table2.pdf (accessed 19/ 06/2017).
- Cothren CC, Moore EE, Hedegaard HB, Meng K. Epidemiology of urban trauma deaths: a comprehensive reassessment 10 years later. World Journal of Surgery 2007; 31: 1507–11.
- Stanworth SJ, Davenport R, Curry N, et al. Mortality from trauma haemorrhage and opportunities for improvement in transfusion practice. British Journal of Surgery 2016; 103: 357–65.
- Glen J, Constanti M, Brohi K, Guideline Development Group. Assessment and initial management of major trauma: summary of NICE guidance. British Medical Journal 2016; 22: 353.
- Hussmann B, Heuer M, Lefering R, et al. Prehospital volume therapy as an independent risk factor after trauma. Biomedical Research International 2015; 2015: 354367.
- Geeraedts LM Jr, Pothof LAH, Caldwell E, de Lange-de Klerk ES, D’Amours SK. Prehospital fluid resuscitation in hypotensive trauma patients: do we need a tailored approach? Injury 2015; 46: 4–9.
- Boffard KD, ed. Manual of definitive surgical trauma care: incorporating definitive anaesthetic trauma care, 4th edn. Boca Raton, FL: Taylor and Francis Group, 2016.
- Holcomb JB. Major scientific lessons learned in the trauma field over the last two decades. PLoS Medicine 2017; 14: e1002339.
- Edwards S, Smith J. Advances in military resuscitation. Emergency Nursing 2016; 24: 25–9.
- Quinn D, Frith D. Assessing the damage control resuscitation: development, drivers and direction. Emergency Medicine Australasia 2015; 27: 485–7.
- Harris T, Thomas GOR, Brohi K. Early fluid resuscitation in severe trauma. British Medical Journal 2012; 345: e5752.
- Carrick MM, Leonard J, Slone DS, Mains CW, Bar-Or D. Hypotensive resuscitation among trauma patients. Biomed Research International. 2016; 2016: 8901938.
- Sharrock AE, Midwinter M. Damage control – trauma care in the first hour and beyond: a clinical review of relevant developments in the field of trauma care. Annals of the Royal College of Surgeons England 2013; 95: 177–83.
- Khan S, Brohi K, Chana M, et al., International Trauma Research Network (INTRN). Hemostatic resuscitation is neither hemostatic nor resuscitative in trauma hemorrhage. Journal of Trauma and Acute Care Surgery 2014; 76: 561–7.
- Bickell WH, Wall MJ Jr, Pepe PE, et al. Immediate versus delayed fluid resuscitation for hypotensive trauma patients with penetrating torso injuries. New England Journal of Medicine 1994; 311: 1105–9.
- Shaftan GW, Chiu CJ, Dennis C, Harris B. Fundamentals of physiologic control of arterial hemorrhage. Surgery 1965; 58: 851–6.
- Cotton BA, Guy JS, Morris JA Jr, Abumrad NN. The cellular, metabolic, and systemic consequences of aggressive fluid resuscitation strategies. Shock 2006; 26: 115–21.
- Dutton RP, Mackenzie CF, Scalea TM. Hypotensive resuscitation during active haemhorrage: impact on in-hospital mortality. Journal of Trauma 2002; 52: 1141–6.
- Hussmann B, Taeger G, Lefering R, et al. Lethality and outcome in multiple injured patients after severe abdominal and pelvic trauma: influence of preclinical volume replacement – an alaysis of 604 patients from the trauma registry of the DGU. Unfallchirurg 2011; 114: 705–12.
- Haut ER, Kalish BT, Cotton BA, et al. Prehospital intravenous fluid administration is associated with higher mortality in trauma patients: a national databank analysis. Annals of Surgery 2011; 253: 371–7.
- Daniel Y, Habas S, Malan L, Escarment J, David JS, Peyrefitte S. Tactical damage control resuscitation in austere military environments. Journal of the Royal Army Medical Corps 2016; 162: 419–27.
- Chang R, Eastridge BJ, Holcomb JB. Remote damage control resuscitation in austere environments. Wilderness Environmental Medicine 2017; 28: S124–34.
- Ravi PR, Puri B. Fluid resuscitation in haemorrhagic shock in combat casualties. Disaster Military Medicine 2017; 3: https://doi.org/10.1186/s40696- 017-0030-2.
- Barnhart G, Cullinan W, Pickett JR. Prolonged field care of a casualty with penetrating chest trauma. Journal of Special Operations Medicine 2016; 16: 99–101.
- Stein P, Kasere A, Sprengel K, et al. Change of transfusion and treatment paradigm in major trauma patients. Anaesthesia 2017; 72: https://doi. org/10.1111/anae.13920.
- Schochl H, Voelckel W, Schlimp CJ. Management of trauma haemorrhage – the European perspective. Anaesthesia 2015; 70(Suppl. 1): 102–9.
- Dutton RP. Management of traumatic haemorrhage – the US perspective. Anaesthesia 2015; 70(Suppl. 1): 108– 12.
- Bridges LC, Waibel BH, Newell MA. Permissive hypotension: potentially harmful in the elderly? A National Trauma Data Bank Analysis. American Journal of Surgery 2015; 81: 770–7.
- Brunauer A, Kok€ofer A, Bataar O, Gradwohl- Matis I, Dankl D, D€unser MW. The arterial blood pressure associated with terminal cardiovascular collapse in critically ill patients: a retrospective cohort study. Critical Care 2014; 18: 719.
- Holcomb JB, Tilley BC, Baraniuk S, et al. Transfusion of plasma, platelets, and red blood cells in a 1:1:1 vs a 1:1:2 ratio and mortality in patients with severe trauma: the PROPRR randomised clinical trial. Journal of the American Medical Association 2015; 313: 471–82.
- Zink KA, Sambasivan CN, Holcomb JB, Chisholm G, Schreiber MA. A high ratio of plasma and platelets to packed red blood cells in the first six hours of massive transfusion improves outcomes in a large multi centre study. American Journal of Surgery 2009; 197: 565–70.
- Godier A, Samama C-M, Susan S. Plasma/platelets/red blood cell ratio in the management of the bleeding traumatised patient: does it matter? Current Opinions in Anaesthesia 2012; 25: 242–7.
- Brohi K, Singh J, Heron M, Coats T. Acute traumatic coagulopathy. Journal of Trauma Injury Infection and Critical Care 2003; 54: 1127–30.
- Cap A, Hunt BJ. The pathogenesis of traumatic coagulopathy. Anaesthesia 2015; 70(Suppl. 1): 96–101.
- Davenport R, Brohi K. Cause of trauma-induced coagulopathy. Current Opinions in Anaesthesia 2016; 29: 212–9.
- Gruen RL, Brohi K, Schreiber M, et al. Haemorrhage control in severely injured patients. Lancet 2012; 380: 1099–108.
- Senthilkumaran S, David SS, Manikam R, Thirumalaikolundusubramanian P. Permissive hypotension in a headinjured multi trauma patient: controversies and contradictions. Journal of Anaesthesiology and Clinical Pharmacology 2015; 31: 428–9.
- Chesnut RM, Marshall LF, Klauber MR, et al. The role of secondary brain injury in determining outcome from severe head injury. Journal of Trauma 1993; 34: 216–22.
- Pigula FA, Wald SL, Shackford SR, Vane DW. The effect of hypotension and hypoxia on children with severe head injuries. Journal of Pediatric Surgery 1993; 28: 310–6.
- Carney N, Totten AM, O’Reilly C, et al. Guidelines for the management of severe traumatic brain injury, fourth edition. Neurosurgery 2017; 80: 6–15.
- Wiles M. Blood pressure in trauma resuscitation: ‘pop the clot’ versus ‘drain the brain’? Anaesthesia 2017; 72: https://doi.org/10.1111/anae.14042.
- Stern SA, Zink BJ, Mertz M, Wang X, Dronen SC. Effect of initially limited resuscitation in a combined model of fluid percussion brain injury and severe uncontrolled haemorrhage shock. Journal of Neurosurgery 2000; 93: 305.
- Hu Y, Wu Y, Tian K, et al. Identification of ideal resuscitation pressure with concurrent traumatic brain injury in a rat model of haemorrhage shock. Journal of Surgical Research 2015; 195: 284–93.
- Gunnar W, Jonasson O, Merlotti G, Stone J, Barrett J. Head injury and haemorrhage shock: studies of the blood brain barrier and intracranial pressure after resuscitation with normal saline solution, 3% saline solution, and dextran-40. Surgery 1988; 103: 398.
- Hariri RJ, Firlick AD, Shepard SR, et al. Traumatic brain injury, haemorrhage shock, and fluid resuscitation: effects on intracranial pressure and brain compliance. Journal of Neurosurgery 1993; 79: 421.
- Vrettos T, Poimenidi E, Athanasopoulos P, et al. The effect of permissive hypotension in combined traumatic brain injury and blunt abdominal trauma: an experimental study in swines. European Review for Medical and Pharmacological Sciences 2016; 20: 620–30.






