Nicholas C. Kanaan, MD; Jeremiah Ray, MD; Matthew Stewart, MD; Katie W. Russell, MD; Matthew Fuller, MD; Sean P. Bush, MD; E. Martin Caravati, MD, MPH; Michael D. Cardwell, MS; Robert L. Norris, MD; Scott A. Weinstein, PhD, MD
Журнал Wilderness & Environmental Medicine,26, 472-487 (2015).
Оригинал статьи
Перевод: Шишкин Константин Георгиевич, врач-хирург, инструктор по горной подготовке, тренер-преподаватель по первой помощи ЧОУ ДПО «Байкальский центр образования», г. Иркутск. Публикуется с согласия автора.
Навигация по статье
Раздел 1: Биологическая характеристика
Раздел 2: Эпидемиология и профилактика
Раздел 3: Помощь в полевых условиях
Раздел 4: Лечение в отделении неотложной помощи
Раздел 5: Ведение ран
Раздел 6: Особые группы пациентов
Источники
Введение
Обществом экстремальной медицины (Wilderness Medical Society, WMS) была созвана рабочая группа экспертов для разработки доказательно обоснованного руководства по профилактике и лечению при укусах гадюковых змей, обитающих на территории Северной Америки. В данном обзоре мы представляем обзор особенностей патофизиологии, обсуждаем меры профилактики и лечения. Проведена градация значимости рекомендаций в отношении каждого из терапевтических методов и его роли в общем лечении. Это руководство должно помогать в принятии клинических решений, однако относиться будет некорректно к нему как к «книге рецептов на все случаи жизни» поскольку каждый пациент уникален и может по-разному реагировать на проводимое лечение. Врачи должны опираться на свой личный опыт и чаще проводить клиническую оценку в динамике, чтоб корректно применять данные рекомендации индивидуально к своим пациентам. Рекомендуется проведение консультаций по ведению пациентов на местном уровне с токсикологом, знакомым с такого рода отравлениями, или токсикологическим центром. Данное руководство относится к ямкоголовым змеям Соединенных Штатов Америки и Канады и не может быть применено к другим видам змей или в иных географических регионах.
Методы
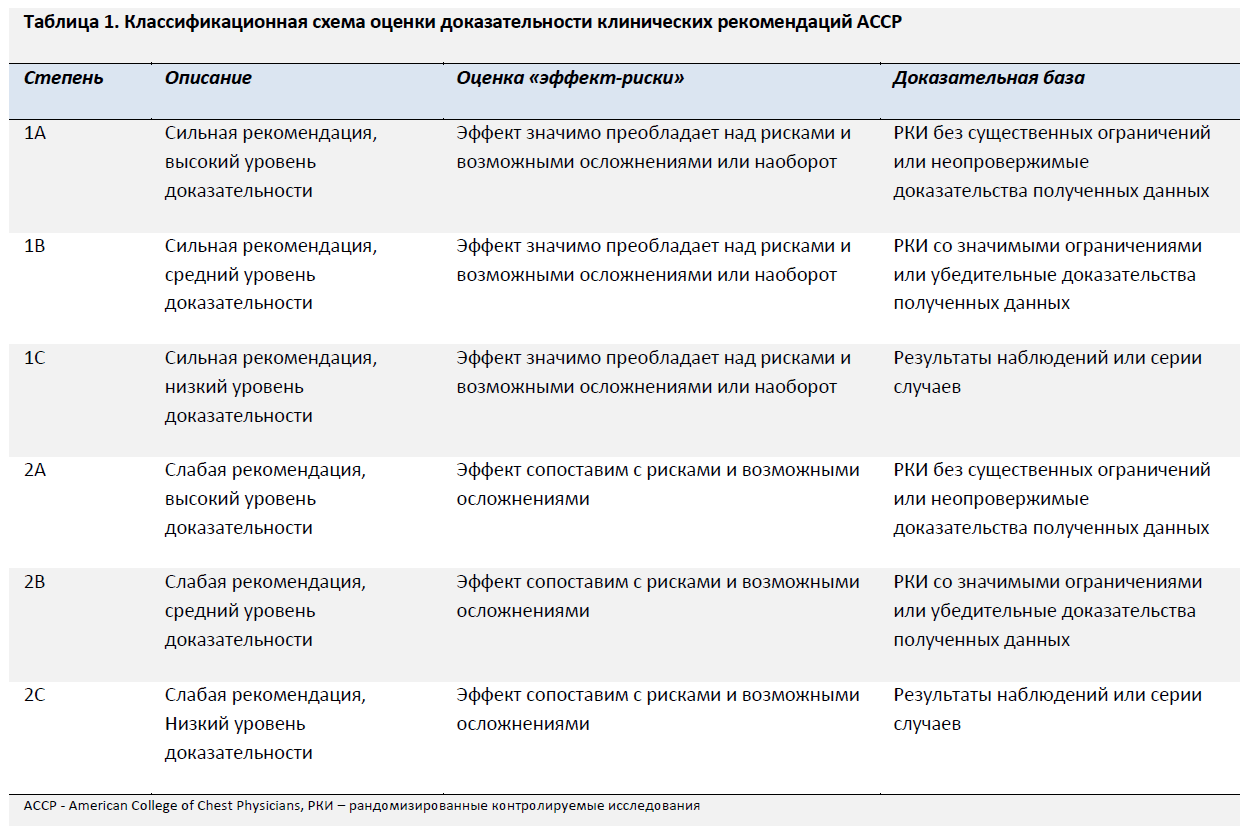
Рабочая группа экспертов была собрана в 2014 году на ежегодном зимнем собрании Общества экстремальной медицины в Парк Сити, штат Юта. Участники рабочей группы были отобраны на основании клинического и исследовательского опыта, а также осведомленности в вопросах укусов змей и включила в себя специалистов по экстренной медицине, хирургии, токсикологии и токсинологии, экстремальной медицине, герпетологии и эволюционной биологии. Соответствующие теме англоязычные статьи за период с 1965 по 2013 год отбирались в базах PubMed и MEDLINE по ключевым терминам (antivenom, copperhead, cottonmouth, crotalid, Crotalinae, crotaline, Crofab, digital dermotomy, envenomation, FabAV, fasciotomy, first aid, pitviper, prevention, rattlesnake, snakebite, treatment, Viperidae). Данные исследований были проанализированы с оценкой уровня доказательности. Рабочая группа использовала модифицированный дельфийский консенсусный метод для разработки рекомендаций с их последующей градацией в соответствии с поддерживающей их доказательной базой и балансом между положительным эффектом и возможным рискам и осложнениям в отношении каждого из терапевтических методов, согласно критериям Американской коллегии врачей-специалистов по заболеваниям грудной клетки (American College of Chest Physicians, ACCP) (Таблица 1).
Раздел 1. Биологическая характеристика
Ядовитые змеи США и Канады
Таксономически семейство Гадюковые (Viperidae) включает распространенное на территории Старого Света подсемейство Гадюковые (Viperinae) и подсемейство Ямкоголовые (Crotalinae), включающее в себя змей с длинными ядовитыми зубами, встречающихся на территории как Старого, так и Нового Света. Ямкоголовые – змеи с характерными теплочувствительными зонами на голове – представлены североамериканскими гремучими змеями (роды Crotalus и Sistrurus) и щитомордниками (род Agkistrodon). Род Crotalus включает в себя практически все виды гремучих змей, в том числе самые крупные, широко распространенные и наиболее опасные виды. В состав рода Sistrurus входит только два вида небольших змей, обитающих на севере Мексики: просяной карликовый гремучник (Sistrurus miliarius) и цепочный карликовый гремучник (Sistrurus catenatus). Водяной (Agkistrodon piscovorus) и медноголовый (Agkistrodon contortrix) щитомордники имеют сходную с гремучниками анатомию, но лишены собственно погремушки и имеют постепенно сужающийся хвост. Все эти змеи имеют крупное тело с треугольной головой, вертикально ориентированные эллиптической формы зрачки, плоские дорсальные чешуйки и одиночный ряд субкаудальных чешуек. Несмотря на то, что эти признаки могут встречаться у различныхнеядовитых змей, такая комбинация плоских дорсальных чешуек и неразделенные субкаудальные чешуйки являются характерным признаком гадюковых США и Канады [2]. Погремушка встречается только у гремучников.
Коралловые змеи являются единственными обитающими на территории США и Канады и отличающимися от вышеописанных крупными представителями ядовитых змей из семейства аспидовых (Elapidae), к которым также относятся кобры, мамбы и крайты. Эти змеи имеют более узкое тело, и их можно идентифицировать по последовательности черных, красных и желтых (или белых) кольцевых полос на теле (они также могут иметь целиком черную окраску) и по отсутствию какого-либо из вышеописанных признаков гадюковых змей [2]. Поскольку лечение при отравлении ядом коралловой змеи отличается от отравлений ядом гадюковых, оно не включено в данное руководство.
Полевые определители видов змей и другие издания описывают около сотни подвидов «опасных» североамериканских змей, однако их таксономия остается окончательно нерешенной, и проводимый в настоящее время генетический анализ способствует более точной характеристике отдельных видов [3]. Некоторые эксперты предлагают объединять мало отличающиеся виды в один [4]. С клинической точки зрения, идентификация змеи на уровне вида или подвида обычно не является необходимой для определения тактики лечения, за исключением нескольких видов: мойавского ромбического гремучника (Crotalus scutulatus), полосатого гремучника (Crotalus horridus) и тихоокеанского гремучника (Crotalus oreganus helleri). В отличие от других представителей рода, они вырабатывают яд, содержащий сильнодействующий мойавский или схожий с ним нейротоксин пресинаптического действия. Укусы змей, вырабатывающих этот токсин, требуют лечения, отличающегося от такового при укусах большинства гадюковых змей США [5, 6].
Знание географической распространенности того или иного вида змеи может помочь с ее идентификацией (Рисунок 1). Фотография укусившей змеи также помогает при последующей ее идентификации экспертом. В то же время не рекомендуется пытаться убить или поймать змею, поскольку это может привести к появлению еще одного пациента, требующего помощи [7]. Если при оценке экспертом выявлено, что укусившая змея не является ядовитой, необходимости в эвакуации нет.

Змеи пойкилотермны (хладнокровны), поэтому они склонны искать убежище от экстремальных значений температур под землей. Вследствие этого в холодную погоду змеи в дикой среде обычно не опасны, за исключением случаев вторжения в их укрытие. По результатам полевых и лабораторных исследований, гадюковые змеи наиболее активны при температуре тела от 25℃ до 30℃ (77 ℉ – 86 ℉) [8-10]. Температура тела змеи в большей степени коррелирует с температурой поверхности, на которой она находится, а не температурой воздуха, а в солнечный день вне тени такая поверхность может нагреваться значительно сильнее, чем воздух [11].
Характеристика яда
Известно, что яд некоторых гадюковых змей включает более 100 различных белков и пептидов, токсичных для жертвы или укушенного человека [12, 13]. Токсичные компоненты яда змеи сильно вариабельны и зависят от вида предполагаемого вида жертвы [14, 15]. Известны случаи значительной вариабельности состава яда между видами [16], в разных географических зонах в пределах одного вида [17-19], в рамках онтогенетических различий у одной особи в разные периоды жизни [20] и даже в пределах потомства одного выводка [21, 22]. Гены, отвечающие за экспрессию токсина, подвержены более быстрым эволюционным изменениям по сравнению с другими генами [16]. Принимая во внимание такую вариабельность состава яда, не представляется возможным предсказать частоту встречаемости в яде того или иного компонента. Но, несмотря на эти ограничения, на основании генетического и молекулярного анализа и клинического опыта все же можно делать общие заключения и давать соответствующие клинические рекомендации [20].
Отмечено, что онтогенетические различия состава змеиного яда коррелируют с изменениями в рационе питания змеи на фоне взросления молодой особи, когда охота на лягушек и ящериц сменяется поеданием преимущественно мелких млекопитающих [23, 24]. С этим фактом может быть связан широко распространенный миф, что молодые гремучники более опасны, чем взрослые особи, поскольку они еще не научились дозировано использовать свой яд. Отдавая должное дозированию яда, все же следует заметить, что мелкие змеи имеют небольшую голову и маленькие железы, и у нет таких резервуаров для яда, какие есть у более крупных змей. Это подтверждается опытом работы лабораторий по получению яда для фармацевтических и научных целей: средняя порция яда, получаемая от 100-сантиметровой змеи, составляет 1100 мг (в пересчете на сухую массу) против 9 мг, получаемых от 30-сантиметровой молодой особи [25], что превышает первую на два порядка. Это соответствует и клиническим данным, а именно: укусы средних и крупных гремучников демонстрируют почти вдвое большую степень тяжести, чем укусы змеями небольшого размера [26].
Раздел 2: Эпидемиология и профилактика
К оглавлению
В США с укусами змей связано до 9000 обращений в отделения неотложной помощи ежегодно. Укусы ядовитых змей составляют примерно одну треть таких обращений, и почти все из них – укусы гадюковых [27]. Точную статистику по укусам змей на территории США собрать сложно. Легко протекающие укусы ядовитыми змеями не попадают в эпидемиологические отчеты. Токсикологические центры консультируют не все случаи укусов змей, и данные по многим случаям укусов не подаются в отчеты лечебными учреждениями. Наконец, неизвестное точно, но, вероятно, значительное число укушенных вообще не обращаются за медицинской помощью, особенно при отсутствии жизнеугрожающих симптомов. Многие эксперты продолжают доверять некоторым статистическим данным, опубликованным Parrish [28] на основании беспрецендентного исследования, включавшего более 5000 госпиталей и 27000 врачей США. Он подсчитал, что в среднем за год по поводу укусов ядовитых змей за период 1958-1959 гг было пролечено 6680 человек [28] На базе работ Parrish и более современных, хоть и не таких значительных, статистических данных, в недавних исследованиях было подсчитано, что частота укусов ядовитых змей в США приблизительно составляет от 7000 до 8000 в год [29] с ежегодной средней летальностью от 5,2 за период с 1991 по 2001 год до 7,4 между 1999 и 2007 годами [31]. В соответствии со свежими данными Американской ассоциации токсикологических центров (American Association of Poison Control Centers, AAPCC), за 2012 год токсикологическими центрами было зафиксировано 6919 укусов змей, 4052 из которых были укусами гадюковых змей. Более половины из последних (57%) имели среднетяжелые или тяжелые последствия, а один случай (укус гремучника) закончился летальным исходом [32]. Эти данные основаны на добровольных отчетах, направляемых в токсикологические центры и, как следствие, не отражают проблему в целом.
Большинство укусов ямкоголовыми змеями происходит при намеренном контакте со змеей в противовес случайным столкновениям, когда человек даже не видел змею [33, 34]. Большинство укушенных – мужского пола, преимущественно белые мужчины в возрасте от 25 до 34 лет, что ставит их в группу наибольшего риска по получению жизнеопасных отравлений [35]. Преднамеренный контакт может нередко быть ассоциирован с алкогольным или наркотическим опьянением [33-36] и обычно происходит, когда люди пытаются поймать, убить дикую змею или поиграться ней, либо во время извлечения и переноски пойманных змей. Более того, следует проявлять осторожность при обращении с мертвой змеей или ее отрубленной головой, поскольку даже в этих случаях кусательный рефлекс может сохраняться [29, 37]. Знание повадок змей и необходимых мер предосторожности в сочетании с правилом не беспокоить этих животных представляется наиболее значимой мерой защиты от нежелательного контакта.
Большинство исследований показывают, что наибольшее количество укусов приходится на верхние конечности, меньше – на нижние конечности, и редко – на область лица, шеи и туловища [27, 34]. Укусы в результате случайных контактов со змеей вовлекают преимущественно нижние конечности, в то время как укусы, связанные с умышленными контактами, чаще локализованы в области рук [27]. Современная защитная одежда и обувь, например, кожаные или жесткие ботинки, обеспечивает защитный барьер от ядовитых зубов, а джинсовая ткань в случае укуса позволяет втрое уменьшить количество впрыснутого яда [38, 39].
Гадюковые змеи являются хищниками, охотящимися почти исключительно из засады [40] и, как следствие, выбирают места, где они с большей вероятностью встретят свою добычу (преимущественно грызунов и других мелких млекопитающих), затем собираются в кольца и неподвижно ждут, пока жертва не окажется на расстоянии эффективного броска [40, 41]. В регионах с суровым зимним климатом змеи вынуждены мигрировать из зимних нор к летним ареалам охоты, в связи с чем для них возрастает риск быть потревоженными человеком [42, 43]. Кинематика укуса и впрыскивания яда обычно различается для оборонительного и нападающего бросков змеи [44], причем почти все укусы человека являются оборонительными. Как результат, знания об охотничьих повадках змей не всегда применимы в отношении укусов человека. Исключение составляют укусы змей, долгое время содержащихся в неволе, когда они часто уже не боятся человека и ассоциируют любое проникновение в клетку с кормлением. Отделение неотложной помощи, столкнувшееся с укусом содержащейся в неволе змеи (нередко принадлежащей к экзотическим видам) должно достоверно идентифицировать змею и найти необходимое противоядие [45]. Небольшое, но все же значимое количество людей держат дома экзотических ядовитых змей, часто незаконно. Эти змеи нередко могут быть изначально идентифицированы неверно, либо реальное название вида змеи может скрываться во избежание проблем с законом. При необходимости достать экзотическое противоядие часто помогает сотрудничество с зоопарком, где содержится тот же вид змеи. Для этих целей существует база данных по противоядиям при укусах экзотических змей, доступ к которой можно получить через ближайший токсикологический центр.
Раздел 3: Помощь в полевых условиях
Первичное лечение и первая помощь
Первым приоритетом после укуса змеи будет предотвращение повторного укуса того же пострадавшего или кого-то еще из людей. Пациента следует убрать подальше от змеи. Следует успокоить пострадавшего, заверив, что смертельные случаи редки, а серьезные последствия обычно предотвратимы. Качественная фотография, осторожно сделанная с безопасного расстояния (равного длине змеи или более), может в ряде случаев быть выслана по мобильной связи эксперту и пригодиться впоследствии для идентификации змеи. В сомнительных случаях выяснение, является укусившая змея ядовитой или нет, играет решающую роль в выборе между простой обработкой поверхностной раны и потенциально опасной и дорогостоящей эвакуацией.
В условиях дикой природы невозможно сделать ничего, что могло бы значимо повлиять на исход серьезного отравления змеиным ядом, и оказание первой помощи не должно препятствовать скорейшей транспортировке пострадавшего в лечебное учреждение, где можно в безопасных условиях ввести соответствующее противоядие [46]. Степень отравления не может быть быстро и достоверно определена на месте, потому любой укус ядовитой змеи должен рассматриваться как неотложная ситуация и повод для немедленного осмотра врачом. Оказание первой помощи и обработка раны может проводиться в процессе транспортировки или ожидания эвакуации.
Следует записать дату и время укуса на теле пациента или в прилагаемом отчете о происшествии. Также стоит измерить окружность пораженной конечности выше и ниже места укуса для последующего сравнения и выявления нарастающего отека [47, 48]. Край эритемы должен быть отмечен для последующего сравнения. Украшения или стесняющие предметы одежды в области укуса должны быть сняты или разрезаны во избежание сдавления тканей по мере нарастания отека. (Уровень рекомендации – 1С)
С ранами после укуса змей следует обращаться так же, как с любыми другими колотыми ранами. Если это не будет задерживать транспортировку, следует быстро промыть рану по стандартной методике (с мылом под струей воды или путем ее ирригации под давлением, либо антисептическим раствором, или же сочетая эти способы) и наложить на нее стерильную повязку для защиты от инфекции [49]. (Уровень рекомендации – 1С)
Исследований, напрямую изолированно оценивающих положительный эффект иммобилизации в качестве самостоятельного метода при укусах змей, не проводилось. Ограничение движений пораженной конечности путем наложения шины (без компрессии) может иметь положительный эффект для пострадавшего, несмотря на отсутствие убедительных данных, поддерживающих применение этой методики. В зависимости от условий транспортировки, поврежденную конечность следует держать примерно на уровне сердца – возвышенное положение может способствовать ускорению системного распространения яда, в то время как в опускание ее вниз может привести к нарастанию отека и усилению местного действия яда. В то же время, такая практика не поддержана какими-либо доказательствами или клиническими исследованиями. Более того, следует поддерживать функциональное положение конечности или сустава в случае развития отека, или если сустав потерял подвижность [50, 51]. (Уровень рекомендации – 2С)
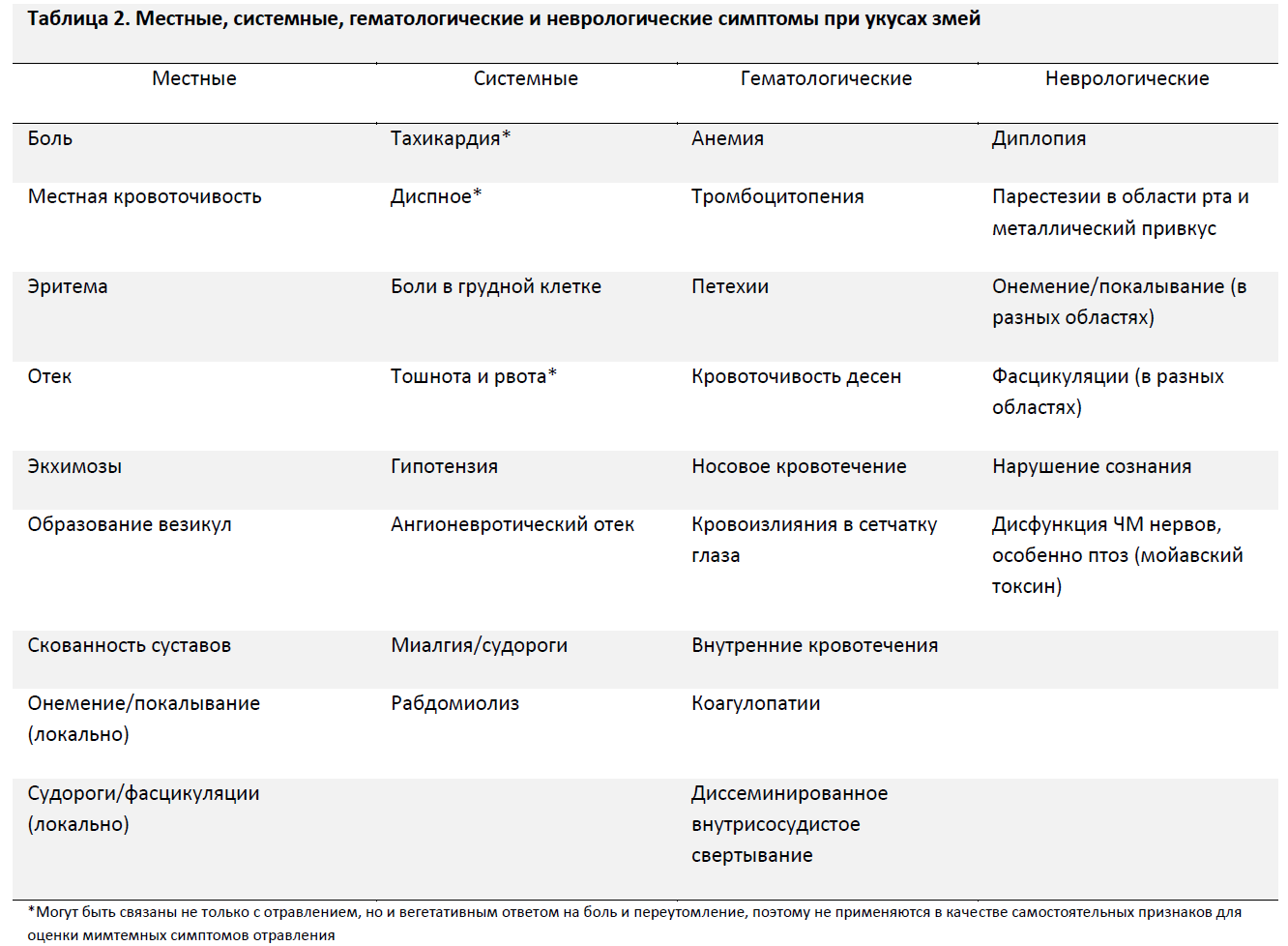
Любые начальные симптомы должны быть тщательно описаны в прилагаемом отчете. Местные признаки должны отмечаться для оценки отрицательной динамики. Местные эффекты гемотоксинов и васкулотоксинов могут приводить к значительной эритеме, отеку и болезненности в области укуса, которые могут распространяться как в дистальном, так и в проксимальном направлении. Местные проявления в пораженных тканях являются наиболее характерными для укусов гадюковых змей и проявляются более чем у 90% пациентов с клинически значимыми отравлениями. (Уровень рекомендации – 1С)
Общие симптомы, включая гипотензию, кровотечения, венозный отек, рвоту и признаки нейротоксического эффекта, говорят о более тяжелом отравлении [52]. Гематологические эффекты связаны со многими факторами и включают в себя деградацию фибриногена, а также агрегацию и разрушение тромбоцитов. Несмотря на то, что у большинства пациентов значительных кровотечений не отмечается, пострадавшего следует тщательно осмотреть на предмет петехий, экхимозов, кровоточивости десен, носового кровотечения, ретинальных кровоизлияний а также признаков более серьезных кровотечений (внутричерепного, внутрибрюшного) [53]. Рвота также может развиться как вегетативная реакция на страх или испуг, что может ввести в заблуждение. Гипотензия может быть результатом вазодилатации и депонирования крови в «третьем» пространстве. Нейротоксичесий эффект действия яда наиболее характерен для мойавского ромбического гремучника (C. scutulatus) и тихоокеанского гремучника (C. helleri), но гораздо менее свойственен другим видам гремучников США [54]. Все укушенные пострадавшие, особенно те, у которых имеется местная или общая симптоматика, должны немедленно транспортироваться в медицинское учреждение для обследования и контроля в динамике (Таблица 2). (Уровень рекомендации – 1С)
К сожалению, существует множество мифов, связанных с оказанием первой помощи при укусах змей, многие из которых могут представлять опасность для пациента. Несмотря на отсутствие доказательств, многие из этих методик были разрекламированы в массовой культуре и исторической медицинской литературе, и поэтому до сих пор часто ошибочно применяются. Описанные ниже методы не приносят пользы или потенциально опасны для пострадавшего.
Высасывание яда ртом
Одно исследование и обзорная статья показали, что высасывание ртом или механическим устройством были неэффективны при моделировании ситуации с «ложным ядом» в экспериментальных условиях на людях, когда удавалось удалить от 0,04% до 2% впрыснутого яда, что клинически не значимо [55]. Более того, высасывание ртом может приводить к бактериальному загрязнению раны и увеличивать вероятность суперинфекции и формирования абсцесса. Наконец, высасывание ртом может представлять опасность для спасателя за счет абсорбции яда через слизистую полости рта [56]. (Не рекомендуется)
Механическое высасывание яда
Экспериментальные исследования показали, что применение механических устройств для высасывания яда может усиливать местное повреждения тканей вокруг раны в месте контакта с устройством, приводя к некрозу и отторжению тканей, что в результате способствует большей потере ткани и увеличению сроков заживления на недели. (Не рекомендуется)
Разрезы и кровопускание в области укуса
Нанесение разрезов или кровопускание в зоне укуса для увеличения размеров раны с целью вымывания яда вытекающей кровью часто усиливает повреждение тканей и местное воспаление, при этом не приносит никакого подтвержденного положительного эффекта [60]. (Не рекомендуется)
Электрический разряд или электротерапия
Однажды была выдвинута теория, что электрический ток может разрушать змеиный яд, однако исследования подтвердили, что электротерапия бесполезна для лечения змеиных укусов, но вредна для пациента [61-63]. (Не рекомендуется)
Криотерапия и местное охлаждение
Криотерапия путем прикладывания льда или другими методами, теоретически, должна замедлять распространение яда, однако эта эффективность данной методики не доказана, а в отдельных крайних случаях это может приводить к усилению местного повреждения тканей [64-66]. (Не рекомендуется)
Наложение жгута
Жгут (как венозный, так и артериальный) может привести к развитию ишемии и гангрены, что увеличивает риск ампутации или потребности в повышенной дозе противоядия, при этом ни одно исследование в итоге не продемонстрировало положительный эффект жгута для пациента [46, 67, 68]. (Не рекомендуется).
Давящая повязка
Клинические доказательства в пользу положительного эффекта компрессии путем наложения давящей повязки эластичным бинтом или ношения бандажа скудные. К тому же сомнительно, что это должно иметь какой-то положительный эффект в случае укусов ямкоголовых змей. Давящая повязка накладывается с целью уменьшения внутритканевого кровотока и замедления поступления яда в системную циркуляцию за счет снижения венозного и лимфатического возврата. В одном из исследований в эксперименте на свиньях, которым вводили летальную дозу яда, иммобилизация с компрессией вызывала увеличение внутритканевого давления после отравления и увеличивала время до летального исхода [69]. Удержание яда в тканях с помощью компрессионной повязки доказательно обосновано только при лечении жизнеугрожающих укусов змей, яд которых нейротоксин (например, австралийских аспидов) [70]. Эти данные не подтверждены для змей США и Канады, яд которых в большей степени вызывает преимущественно местные повреждения тканей, а компрессионная повязка может, наоборот, усиливать этот процесс. Одно исследование на животных выявило развитие закончившейся летальным исходом гиперкалиемии после снятия давящей повязки [72, 73]. Еще два исследования выявили, что доктора и случайные очевидцы редко накладывают давящую повязку правильно [72, 73], а третье показало, что даже после обучения практикующим медикам не удается добиться эффективной иммобилизации при имитации случаев укуса змеи [74]. Эффективность давящей повязки при укусах ямкоголовых змей в клинических исследованиях и сериях случаев доказательно не подтверждена [75, 76]. (Не рекомендуется)
Сухой укус
Ядовитые змеи также могут не впрыскивать яд в рану в случаях, обычно обозначаемых как «сухие» укусы, на которые может приходиться 25% и более от общего числа укусов ямкоголовых змей [25, 77]. Длительность контакта с ядовитым зубом также может влиять на количество яда, в случае как защитного броска, так и охотничьего нападения змеи, причем количество яда при защитном укусе (например, человека) показало бо́льшую вариабельность и часто превышало таковое в ситуации нападения [78, 79]. Изначально определить, был ли это сухой укус, или яд все же поступил в ткани, может быть затруднительно. Никогда не следует рассматривать ситуацию как сухой укус; показано динамическое наблюдение и лабораторное обследование, необходимое для выявления возможного развития клиники отравления. При наличии следов от ядовитых зубов и идентификации ядовитой змеи, ситуацию следует рассматривать как отравление, и показано немедленное обращение за медицинской помощью, поскольку промедление сопряжено с ростом частоты развития осложнений и летальности. Если эвакуация затруднена или откладывается, отсутствие местных или общих симптомов спустя 8 часов после укуса может говорить о том, что он был сухим. (Уровень рекомендации – 1С)
Принятие решения об эвакуации
Общее правило – все укушенные ядовитыми змеями пострадавшие должны быть эвакуированы и доставлены в ближайшее отделение неотложной помощи. Скорейшая транспортировка в отделение неотложной помощи позволяет провести необходимые медицинские вмешательства по спасению жизни и конечности. Если спасатель знаком с видами ядовитых змей, распознавание того, что укус был нанесен неядовитой змеей, исключает необходимость эвакуации. В то же время такая идентификация должна быть достоверной. Даже хорошо подготовленный спасатель может быть не способен оценить степень тяжести отравления при змеином укусе или его возможные последствия, поэтому применение «выжидательной» тактики не рекомендуется. (Уровень рекомендации.- 2С)
Следует использовать любую возможность для эвакуации пострадавшего от укуса змеи. В то же время, в случае нахождения пациента в удаленном районе при затрудненной эвакуации решение об эвакуации следует принимать взвешенно, учитывая безопасность пациента и спасателя, вероятность успешной эвакуации, а также наличие ресурсов для ее обеспечения. Транспортировка в лечебное учреждение, где нет возможности ввести противоядие, может оказаться малополезна для пострадавшего. Ближайшее учреждение должно быть заранее проинформировано о пациенте, и, если противоядие в нем отсутствует, оно может быть доставлено из другой больницы, или же пациенту будет показана транспортировка в другое учреждение. Весь процесс эвакуации можно также координировать в содействии с токсикологическим центром. (Уровень рекомендации – 1С)
Раздел 4: Лечение в отделении неотложной помощи
Первичное обследование пациента
По прибытию в отделение неотложной помощи укушенным змеей пациентам должна быть проведена быстрая оценка состояния – проходимости дыхательных путей, дыхания, кровообращения. После быстрой оценки состояния и витальных показателей пациенту следует проводить мониторинг сердечной деятельности, артериального давления и пульсоксиметрии. Следует провести подробный опрос пациента или свидетелей на предмет точного времени укуса и симптомов отравления. Очень важно снять стесняющие предметы одежды или украшения в связи с риском нарастания отека [7]. Следует отметить края болезненности, эритемы и отека, а также замерить окружность конечности выше и ниже места укуса для последующей оценки динамики. Впоследствии это следует делать каждые 15-30 минут, пока местная реакция не стабилизируется. (Уровень реакции – 1С)
Местное лечение раны и антибиотикотерапия
Во время укуса с ядовитых зубов возможна контаминация раны аэробными и аэробными бактериями [80]. Несмотря на это, раневая инфекция развивается только в 3% случаев укусов гадюковых змей [81]. Проводилось проспективное исследование, сравнивающее эффективность профилактической антибиотикотерапии после укусов змей с ее отсутствием, которое показало отсутствие значимых различий в частоте развития инфекции в обеих группах [82]. Один анализ выявил что частота развития раневой инфекции после укусов ямкоголовых змей на фоне антибиотикопрофилактики составила 0% [83]. Рандомизированное контролируемое исследование показало, что хлорамфеникол не снижает частоту формирования абсцессов как осложнения укусов гадюковых змей [84]. На основании современных доказательных данных, профилактическая антибиотикотерапия при змеиных укусах не рекомендована, и антибиотики должны применяться только при признаках развивающейся инфекции, например, нагноения (другие признаки инфекционного процесса могут быть обусловлены местным действием яда на ткани). (Уровень рекомендации – 1С)
Любая значимая открытая рана должна быть накрыта влажной повязкой, которую следует менять дважды в день. Обширные некротические поражения следует вести на повязках с вакуум- аспирацией [49]. Рекомендована ранняя активная и пассивная лечебная физкультура, а также скорейшее возвращение к профессиональной деятельности, особенно в случаях укусов кисти и пальцев, для предотвращения развития контрактур и стойкого нарушения функции [83]. (Уровень рекомендации – 1С)
С целью обезболивания предпочтительны опиоиды. Аспирин и нестероидные противовоспалительные препараты относительно противопоказаны ввиду возрастающего риска кровотечения, дисфункции тромбоцитов и потенциально возможных предпочечных эффектов у пациентов с рабдомиолизом [50, 86, 87]. (Уровень рекомендации – 1С)
Несмотря на отсутствие описанных случаев развития столбняка после укуса змей, пациентам следует проводить противостолбнячную иммунизацию в соответствии с рекомендациями Центров по профилактике и контролю за заболеваниями (Centers for Desease Control and Prevention) [88]. Коррекция коагулопатии перед введением противостолбнячной сыворотки будет способствовать уменьшению кровоточивости из места инъекции. (Уровень рекомендации – 1С)
Инструментальное и лабораторное обследование
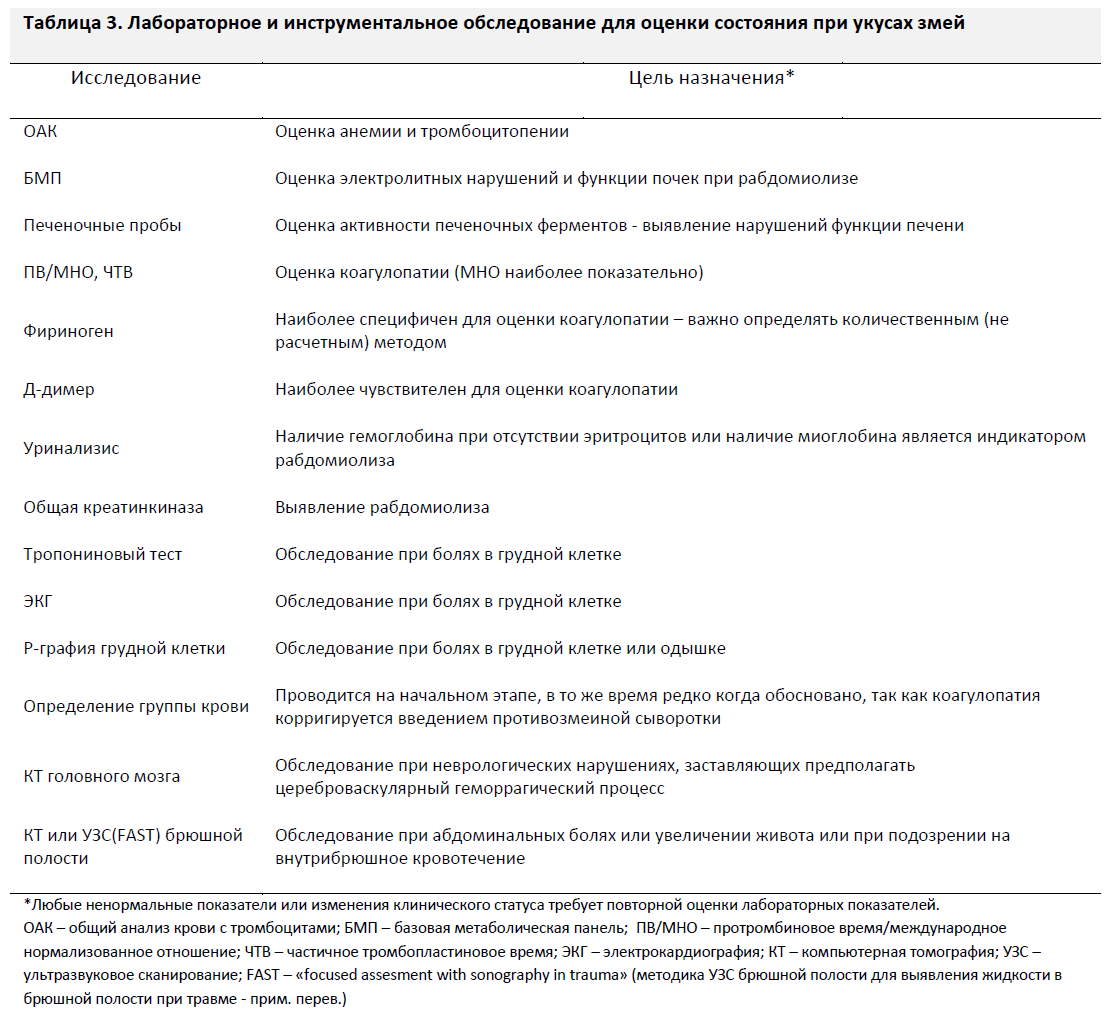
При подозрении на отравление следует обеспечить венозный доступ на интактной конечности и провести лабораторное обследование: полный подсчет форменных элементов крови с тромбоцитами, базовую метаболическую панель, печеночные пробы, протромбиновое время/международное нормализованное отношение (ПВ/МНО), частичное тромбопластиновое время, фибриноген, д-димер, общую креатинкиназу, и мочевые пробы (Таблица 3). Эти исследования позволят получить основные лабораторные данные для последующей оценки динамики и помогут выявить анемию, тромбоцитопению, признаки коагулопатии или рабдомиолиза. У тяжелых пациентов с болью в грудной клетке или одышкой дальнейшее обследование включает электрокардиографию в 12 отведениях, рентгенографию грудной клетки и тропониновый тест. Если у пациента выявлена протеинурия, следует взять анализы на миоглобинурию и микрогематурию. При наличии миоглобинурии или выраженного отека мышц, показана оценка показателей общей креатинкиназы в динамике для оценки тяжести рабдомиолиза. Врачам следует сравнивать данные неврологического осмотра в динамике и назначать бесконтрастную компьютерную томографию головного мозга при выявлении каких- либо признаков неврологического дефицита или при подозрении на геморрагический цереброваскулярный процесс. Пациентам с потенциально опасными абдоминальными симптомами следует проводить ультразвуковое сканирование или компьютерную томографию органов брюшной полости для выявления возможного внутрибрюшного кровотечения [50] (Уровень рекомендации – 1B).
Лабораторные исследования в динамике, включающие подсчет форменных элементов, базовую метаболическую панель, PT/INR, д-димер, общую креатинкиназу и фибриноген, должны проводиться всем пациентам, укушенным гадюковыми змеями. При подозрении на сухой укус пациент должен находиться под наблюдением в течение не менее 8 часов и выписываться только после проведения повторного лабораторного контроля, при условии нормальных витальных показателей. При малых отравлениях пациенты должны находиться под наблюдением в течение 12-24 часов с лабораторным контролем каждые 4-6 часов. Пациентам с тяжелыми и средней тяжести отравлениями должны получать противозмеиную сыворотку, госпитализированы в стационар с проведением лабораторного контроля каждые 4 часа после поступления [50] (Уровень рекомендации – 1C)
Показания для введения противоядия
Введение противоядия и поддерживающая терапия являются основными мероприятиями помощи при укусах ямкоголовыми змеями. Поливалентная овечья сыворотка против яда ямкоголовых змей (FabAV) одобрена Управлением по санитарному контролю за качеством пищевых продуктов и медикаментов Соединенных Штатов в 2000 году. При ее применении возникает меньше побочных реакций, чем в случае с применявшейся ранее лошадиной поливалентной сывороткой. FabAV действует путем связывания и нейтрализации яда ямкоголовых змей в кровеносном русле, а также за счет диффузии в интерстициальное пространство и предотвращения прогрессирования локального повреждения тканей. Несмотря на то, что существовавшие ранее инструкции для принятия решения предписывали использовать шкалу оценки тяжести отравления змеиным ядом, в настоящее время рекомендуется вводить противозмеиную сыворотку любому укушенному змеей пациенту с прогрессирующими симптомами отравления [50].
Пациенты после сухого укуса, а также лица, не укушенные змеей, не должны получать противозмеиную сыворотку. Пациенты с отравлением легкой степени, проявляющимся отеком и локальным болевым синдромом в области укуса, должны находится под пристальным наблюдением, и им не должна вводиться противозмеиная сыворотка, если местные симптомы не прогрессируют [50]. Укусы в области анатомических зон высокого риска (таких как кисти рук, суставы, лицо) могут потребовать более консервативного подхода в виде расширения показаний для введения противозмеиной сыворотки, так как местные проявления в этих зонах могут иметь более тяжелые и длительные последствия [89]. (Уровень рекомендации – 1C)
Пациенты с прогрессирующими местными симптомами или какими-либо признаками системной интоксикации (жалобы, симптомы или лабораторные сдвиги) должны получать противозмеиную сыворотку. Прогрессирование отравления при укусах гадюковыми змеями определяется как нарастание местной симптоматики (распространение эритемы ≥2 см), симптомы системной интоксикации или ненормальные показатели при лабораторном исследовании. Отравления средней степени тяжести включают в себя укусы, сопровождающиеся сильной локальной болью, нарастающим отеком, легко или умеренно выраженными не жизнеугрожающими общими симптомами, а также лабораторными признаками коагулопатии без геморрагического синдрома. Тяжелые отравления включают в себя укусы со значительным отеком и болевым синдромом, жизнеугрожающими общими симптомами, сдвигами на коагулограмме, сопровождающимися
значимыми кровотечениями. Наиболее характерные системные симптомы включают гипотензию, системные кровотечения или неврологическую симптоматику. Разнообразные симптомы нейротоксического или миотоксического действия яда могут быть представлены парестезиями в области рта, мышечными подергиваниями, нарушениями психического статуса или судорогами
[90]. Обо всех пациентах, получивших противозмеиную сыворотку, следует сообщать клиническому токсикологу или в токсикологический центр (США (800)222-1222, Британская Колумбия (800)567-8911, Онтарио (800)268-9017, Квебек (800)463-5060). (Уровень рекомендации – 1А).
Введение противоядия
Начальная дозировка FabAV включает 4-6 стандартных доз, каждая из которых разводится в 25 мл стерильного 0,9% раствора хлорида натрия и тщательно перемешивается путем аккуратного переворачивания флакона на 180 градусов и обратно до полного растворения порошка. Несмотря на то, что производителем рекомендовано разводить препарат на 18 мл раствора, использование 25 мл ускоряет процесс растворения [91]. Сразу после растворения эти 4-6 стандартных доз разводятся физиологическим раствором до 250 мл. Затем следует ввести внутривенно 25 мл полученного раствора в течение 10 минут, и, при отсутствии аллергических реакций, оставшуюся часть следует вводить инфузией в течение 1 часа [92]. Доза препарата подбирается на основе количества введенного яда, а не по массе тела пациента, поэтому детская дозировка не отличается от взрослой. У детей с массой тела менее 10 кг, у которых возможна объемная перегрузка жидкостью, препарат может быть разведен в меньшем объеме – около 20 мл/кг [93] (Уровень рекомендации – 1A).
Абсолютных противопоказаний для введения FabAV нет, поскольку положительный эффект от противоядия превышает по значимости риск осложнений в виде аллергических реакций на FabAV или гиперчувствительности к папаину или экстрактам папайи. Папаин используется для расщепления антител на Fab и Fc сегменты, при этом незначительное количество его может оставаться в готовом препарате [94]. В этих случаях пациентам должна проводиться профилактическая противоаллергическая терапия и тщательный мониторинг (см. Раздел 6). (Уровень рекомендации – 1B)
Очень важно своевременно проводить первичную оценку степени отравления ядом ямкоголовых. У практически 88% пациентов, пролеченных с помощью противозмеиной сыворотки, показатели обследования в динамике вернулись к исходному уровню, что выражалось в отсутствии нарастания отеков и развития экхимозов, улучшении жизненных показателей, уменьшении симптомов общей интоксикации и стабилизации развивающийся коагулопатии [92]. В добавление к этому, в течение 1 часа после введения сыворотки должна проводиться повторная оценка витальных показателей, локального статуса и повторные лабораторные исследования (ОАК, ПВ/МНО, ЧТВ и уровень фибриногена) с целью оценки ответа на препарат. При прогрессировании местной или общей симптоматики или при ухудшении лабораторных показателей в течение первого часа следует ввести дополнительно от 4 до 6 стандартных доз препарата до достижения исходных показателей [95]. Согласно проведенным исследованиям, для достижения целевых показателей может потребоваться от 4 до 18 стандартных доз FabAV [92]. (Уровень рекомендации – 1А)
Порядок выписки пациентов
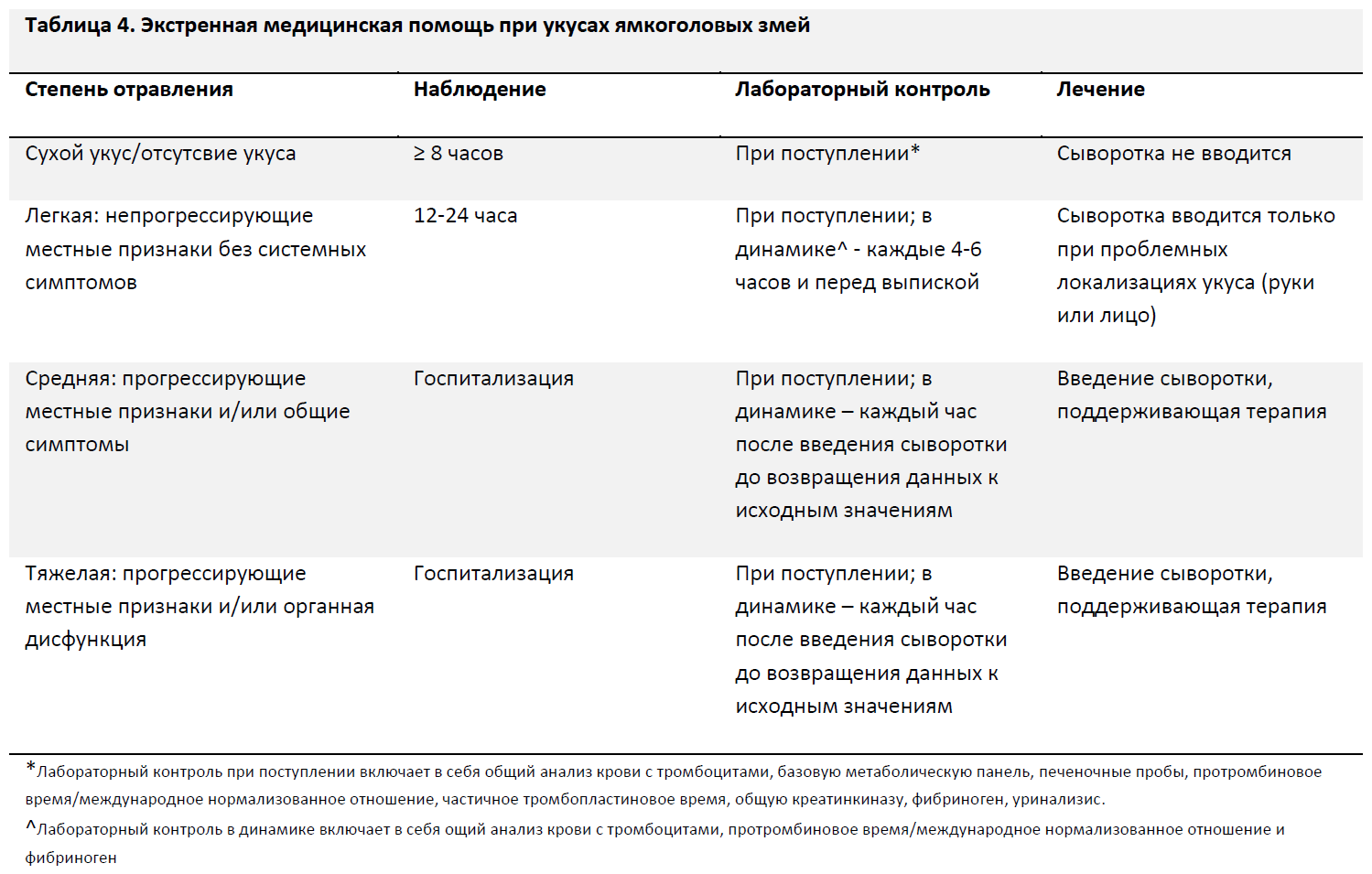
Сухие укусы без признаков прогрессии отравления при наличии обычной раны должны находиться под наблюдением не менее 8 часов с проведением лабораторного контроля в процессе наблюдения для выявления возможных поздних признаков действия яда. Пациенты, поступившие в поздние сроки (более 8 часов с момента укуса), должны находиться под наблюдением в течение 2-4 часов с оценкой лабораторных показателей. На момент выписки пациенты должны иметь нормальные витальные показатели и отсутствие патологических изменений или сдвигов в динамике при лабораторном обследовании. (Уровень рекомендации – 1С)
Пациенты с легкими отравлениями (характеризующимися локальной болезненностью, умеренным отеком, отсутствием системных проявлений и нормальными лабораторными показателями) должны находиться под наблюдением в течение 12-24 часов, и им также должен проводиться лабораторный контроль при выписке [50]. К другим факторам, которые могут влиять на сроки наблюдения, относятся возраст пациента, сопутствующие заболевания, локализация укуса и возможность доступа к медицинской помощи (Таблица 4). (Уровень рекомендации – 1С)
При выписке пациентов, которые были госпитализированы и получали лечение противозмеиной сывороткой, следует убедиться в отсутствии у них сывороточной болезни или отсроченной коагулопатии. Следует давать четкие указания повторно обратиться немедленно при любых признаках прогрессирующего отравления. Выписанным пациентам должен повторно проводиться лабораторный контроль (ОАК, ПВ/МНО, фибриноген) амбулаторно на 2-3 и 5-7 дни с момента введения последней дозы противоядия для исключения поздних проявлений отравления или рецидивной коагулопатии [54, 97]. Таким пациентам также в течение 2 недель противопоказано занятие контактными видами спорта, удаление зубов, татуаж или пирсинг, а также плановые хирургические вмешательства (Уровень рекомендации – 1B)
Раздел 5: Ведение ран
К оглавлению
Раны после укусов гадюковых змей могут быть значительными и требовать неотложного или последующего длительного лечения. Общие компоненты яда ямкоголовых змей способствуют развитию отека, геморрагий, а иногда и некроза в области укуса. При имеющейся широкой доступности противоядий экстренная хирургическая коррекция при укусах змей требуется крайне редко [66].
Хирургическая обработка раны
Подавляющее большинство пациентов после укусов ямкоголовыми змеями выздоравливают без хирургического вмешательства. Изредка тяжелые отравления при укусах змей рода Crotalus требуют оперативного вмешательства с целью хирургической обработки раны, в то время как укусы медноголового щитомордника редко приводят к ранам, требующим хирургической обработки [98]. Исторически агрессивная хирургическая тактика ошибочно рассматривалась как подход, позволяющий оценить рану, уменьшающий выраженность болевого синдрома, предотвращающий развитие компартмент-синдрома и дальнейшее омертвение тканей [99]. В серии случаев 54 пациентов, которым проводилась эксцизия тканей с геморрагическими изменениями, частота осложнений была значительно выше, чем при проведении только консервативного лечения [100]. При гистологическом исследовании иссеченных тканей были обнаружены как некротизированные, так и живые мышечные волокна, свидетельствующие, что такая ткань может регенерировать [101, 102]. Ввиду высокого риска осложнений, сопровождающих хирургическое лечение, а также на фоне прогресса в лекарственном лечении укусов змей, на раннем этапе хирургические вмешательства противопоказаны. Иссечение тканей не должно производиться рутинно, однако удаление некротических тканей и геморрагических везикул на 3-5 день, согласно общепринятым в хирургии принципам, может иметь положительный эффект [103]. При развитии вторичной инфекции может возникнуть необходимость в более широком иссечении тканей и назначении антибиотикотерапии. (Уровень рекомендации – 1B).
Компартмент-синдром: фасциотомия и пальцевая дермотомия
Истинный компартмент-синдром относится к редким осложнениям при укусах змей. В то же время он может приводить к стойкой потере трудоспособности в случае поздней его диагностики. Диагностировать компартмент-синдром бывает сложно, поскольку ранние его признаки, такие как боль при пассивном сгибании или напряжение мышц конечности, идентичны таковым при укусе ямкоголовых змей. Патофизиологические изменения в тканях, происходящие при действии змеиного яда отличается от таковых при компартмент-синдроме и вызваны развитием поверхностного отека и воспаления в большей степени в подкожной клетчатке, чем в субфасциальных пространствах. В то же время в случаях, когда яд накапливается в пределах мышечного компартмента, введение противозмеиной сыворотки может предотвращать или купировать развитие компартмент-синдрома [66]. В целом, проведение фасциотомии с целью снижения внутритканевого давления показано только в редких случаях и обычно не рекомендуется, уступая место более предпочтительному введению противоядия [103-106]. В экспериментальном исследовании на кроликах введение противозмеиной сыворотки показало лучший эффект в плане сохранения мышечной функции по сравнению как с фасциотомией, так и в случае сочетания фасциотомии с введением противоядия [102]. В серийном исследовании 550 пациентов, укушенных змеями, ни один из них не потребовал проведения фасциотомии [80], а поданным еще одного обзора, фасциотомия была проведена только в 2-х из 1257 случаев [101]. (Уровень рекомендации – 1B)
Динамическое наблюдение должно проводиться в течение 36 часов, поскольку выраженность отека в эти сроки максимальная. При наличии подозрения на развитие компартмент-синдрома, например, при выраженном отеке, не купирующемся на фоне введения адекватной дозы противозмеиной сыворотки или при развитии соответствующих клинических симптомов (нарастающая боль, парестезии, бледность и пр.), следует провести измерение тканевого давления. Если внутритканевое давление превышает 35-40 мм рт.ст., следует поставить предположительный диагноз «компартмент-синдром» и назначить консультацию хирурга [107]. Поскольку нет единого консенсуса по поводу того, при каких показателях внутритканевого давления следует ставить диагноз «компартмент-синдром», в случае подозрения на развитие этого осложнения следует тщательно оценивать клинические признаки и измерение внутритканевого давления в динамике. Необходимо повторно ввести противозмеиную сыворотку (4-6 стандартных доз) и наблюдать за конечностью на предмет нейроваскулярных изменений, а также повторно измерять внутритканевое давление. Раннее и активное применение противозмеиной сыворотки практически всегда предотвращает необходимость фасциотомии. В то же время, в редких случаях, когда пациент не отвечает на лечение, решение о проведении фасциотомии должно приниматься хирургом в сроки до 6 часов при наличии нейрососудистых нарушений на фоне роста внутритканевого давления, даже несмотря на введенное противоядие [66]. (Уровень рекомендации – 1С)
Пальцы ввиду их малого диаметра имеют ограниченное пространство для развития в них отека. Змеиные укусы с вовлечением пальцев описаны в 21% случаев[107]. Точного метода измерения внутритканевого давления в пальцах не существует. В то же время напряженный отек, бледность, отсутствие чувствительности в пальце при плохом капиллярном наполнении заставляет с большей долей вероятности заподозрить компартмент-синдром. Решение о проведении дермотомии должно опираться на исследование нейрососудистого статуса и данных ультразвуковой допплерографии сосудов пальца [66]. При наличии показаний для дермотомии, она проводится в виде продольного рассечения только кожи от основания до уровня дистального межфалангового сустава и может выполняться под местной анестезией. Как и в случае с фасциотомией, необходимость в проведении дермотомии возникает редко. (Уровень рекомендации – 1С)
Раздел 6: Особые группы пациентов
Беременные женщины
Беременные женщины при укусе гадюковыми змеями должны наблюдаться в тесном сотрудничестве с акушерами-гинекологами. Отравления змеиным ядом могут приводить к осложнениям со стороны плода, и до 20% описанных отравлений во время беременности привели к внутриутробной смерти плода (как в случаях введения противозмеиной сыворотки, так и без нее). Побочных реакций на введение противозмеиной сыворотки со стороны матери или плода не описано, однако, отдавая должное патофизиологии отравления, плод имеет больший риск для развития осложнений, связанных с коагулопатией, например, отслойки плаценты [109]. В связи с этим пациенткам после укуса змеи на фоне беременности должна вводиться противозмеиная сыворотка по схеме на фоне обследования и мониторинга плода [110]. (Уровень рекомендации – 1С)
Дети
Дети должны получать противозмеиную сыворотку в той же дозе, что и взрослые. Сыворотка обезвреживает змеиный яд, и поэтому ее доза рассчитывается исходя из количества введенного яда, а не на массу тела пациента. Противозмеиная сыворотка продемонстрировала безопасность при применении ее у детей всех возрастных групп [93, 111-115]. (Уровень рекомендации – 1B)
Аллергические или анафилактические реакции
Реакции гиперчувствительности и сывороточная болезнь в ответ на введение противозмеиной сыворотки (при лечении FabAV) отмечены в 8% и 13% соответственно [116]. Некоторые из них могут протекать в тяжелой форме, и медицинский персонал должен быть готов к введению эпинефрина (адреналина), стероидов, антигистаминных препаратов и экстренному обеспечению проходимости дыхательных путей [7]. Сразу после купирования аллергической реакции ослабление эффекта действия яда выходит на первый план по значимости, и врачу следует продолжить медленное введение оставшегося количества противоядия (потенциальный положительный эффект в этом случае может иметь большее разведение сыворотки до 1000 мл в противовес обычным 250 мл). (Уровень рекомендации – 1С)
Превентивное введение прометазина, гидрокортизона или преднизолона в рандомизируемом контролируемом исследовании не продемонстрировала эффекта в виде снижения количества побочных реакций на противозмеиную сыворотку [117]. Несмотря на то, что гидрокортизон в сочетании с хлорфенирамином или эпинефрином (адреналином) могут снижать риск развития побочных реакций, применение таких комбинаций изучалось в сочетании с противозмеиными сыворотками не овечьего происхождения и показало значительно большую частоту развития анафилактических реакций [118, 119]. Предварительное введение противоаллергических препаратов с целью профилактики аллергических реакций должно проводиться у пациентов с аллергией на противозмеиную сыворотку в анамнезе, а также решение о ее проведении может приниматься в отношении пациентов с сопутствующей астмой, атопией или мультивалентной аллергией. (Уровень рекомендации – 1B)
Пациенты в критическом состоянии
У пациентов в тяжелом состоянии поддерживающая терапия и введение противозмеиной сыворотки являются ключевыми направлениями лечения. Вазодилатация, плазмопотеря на уровне капилляров, формирование «третьего пространства» или геморрагические осложнения могут приводить к гипотензии и шоку, требующим инфузионной терапии. Коррекция дегидратации путем внутривенного введения кристаллоидных растворов должно начато одновременно с введением противоядия, поскольку противозмеиная сыворотка является основным методом лечения [120]. Если гипотензия продолжает сохраняться, несмотря на введение противозмеиной сыворотки и инфузионную терапию, для поддержки гемодинамики рекомендовано применение вазопрессоров (Уровень рекомендации – 1B)
Нейротоксические симптомы при укусе таких видов змей, как мойавский ромбический гремучник (Crotalus scutulatus), могут быть сильно выраженными. В то же время, противозмеиная сыворотка имеет относительно слабую эффективность в отношении купирования пресинаптической нейротоксичности. Это в большей степени справедливо в отношении пациентов с поздно выявленными симптомами парлича, самым ранним из которых является птоз [6]. Пациенты с симптомами паралича должны быть тщательно обследованы. Интубация и искусственная вентиляция легких при наличии показаний должна проводиться на раннем этапе, так как это может оказаться жизнеспасающей процедурой. (Уровень рекомендации – 1С)
Острая почечная недостаточность вследствие рабдомиолиза может быть купирована стандартными методами форсированной гидратации, защелачивания мочи и, по показаниям, диализа [121]. (Уровень рекомендации – 1С)
Дыхательная недостаточность (не связанная с анафилаксией) была зарегистрирована у 8% пациентов в критическом состоянии после отравления, из них 4% потребовали механической вентиляции с целью респираторной поддержки [122]. (Уровень рекомендации – 1B).
Трансфузия компонентов крови (эритроцитарной массы, свежезамороженной плазмы, криопреципитата и тромбоцитарной массы) может быть полезна для поддержания нормальных значений гематокрита и в случае выраженного геморрагического синдрома. В то же время, в отличие от противозмеиной сыворотки, трансфузия компонентов крови не купирует и даже не уменьшает выраженность коагулопатии. Поэтому введение сыворотки должно проводиться на самом раннем этапе и рассматриваться в качестве основного ключевого направления лечения, а трансфузионная терапия остается лечебным резервом на случай развития тяжелых угрожающих жизни кровотечений или анемии, устойчивой к лечению противозмеиной сывороткой [123]. (Уровень рекомендации – 1С)
В литературе описаны также редкие и нехарактерные осложнения укусов змей. Описан случай развития гиперкоагуляции с развитием множественной тромбоэмболией ветвей легочной артерии, возникшей после изначальной гипокоагуляции с гипофибриногенемией [124]. В нескольких исследованиях представлены случаи отравления, при которых отмечено отсутствие линейной зависимости купирования тромбоцитопении при увеличении дозы вводимой сыворотки [125]. Описано два случая обширного ишемического инсульта после применения поливалентной сыворотки против яда ямкоголовых змей Fab (овечьей) после укуса гремучими змеями [126]. Обзор литературы выявил, что в 0,5% случаев после укусов ямкоголовыми змеями, при которых проводилось лечение противозмеиной сывороткой, возникли поздние осложнения, потребовавшие повторной госпитализации, такие как кровотечения, потребовавшие проведения гемотрансфузии [127], а также один случай, закончившийся смертельным исходом [128]. Исследуемая в настоящий момент лошадиная F(ab)2 сыворотка против яда ямкоголовых змей, пока не поступившая в продажу, показала потенциальную возможность снижения риска развития подобных подострых коагулопатий и кровотечения [129]. При возникновении подобных геморрагических осложнений может потребоваться повторное введение противозмеиной сыворотки (Уровень рекомендации – 2С)
Заключение
Укусы гадюковых змей могут приводить к тяжелым осложнениям и летальному исходу, и поэтому должны лечиться в соответствии с четкими доказательно-обоснованными стандартами. Укусы ямкоголовых змей чаще всего оказывают местный эффект в виде отека и повреждения тканей, а также могут проявляться системными эффектами (включая коагулопатию, нейротоксиичность или гипотензию). Прогрессирование данных эффектов может быть остановлено своевременным введением противозмеиной сыворотки.
Более серьезные отравления характеризуются выраженными местными проявлениями и жизнеопасными системными сдвигами, которые требуют повторного введения сыворотки и тщательно контролируемой поддерживающей терапии. Частые осмотры в динамике и тщательная фиксация границ прогрессирования местного поражения тканей или лабораторных показателей играют значительную роль в лечении после укусов змей. Консультация токсиколога или токсикологического центра имеют важное значение для правильного лечения.
И в заключение, данное руководство посвящено ямкоголовым змеям США и Канады и не может быть безопасно применено по отношению к другим видам или географическим регионам.
Источники
- Guyatt G, Gutterman D, Baumann MH, et Grading strength of recommendations and quality of evidence in clinical guidelines: report from an American College of Chest Physicians’ task force. Chest. 2006;129:174–181.
- Cardwell Recognizing dangerous snakes in the United States and Canada: a novel 3-step identification method. Wilderness Environ Med. 2011;22:304–308.
- Torstrom SM, Pangle KL, Swanson Shedding subspecies: the influence of genetics on reptile subspecies taxonomy. Mol Phylogenet Evol. 2014;76:134–143.
- Douglas ME, Douglas MR, Schuett GW, Porras LW, Holycross Phylogeography of the Western rattlesnake (Crotalus viridis) complex, with emphasis on the Colorado Plateau. In: Schuett GW, Höggren M, Douglas ME, Greene HW, eds. Biology of the Vipers. Eagle Mountain, UT: Eagle Mountain Publishing; 2002:11–50.
- Weinstein SA, Minton SA, Wilde 1985. The distribution among ophidian venoms of a toxin isolated from venom of the Mojave rattlesnake (Crotalus scutulatus scutulatus). Toxicon. 1985;23:825–844.
- Weinstein SA, Dart RC, Staples A, White Envenomations: an overview of clinical toxinology for the primary care physician. Am Fam Phys. 2009;80:793–802.
- Costello MW, Heins A, Zirkin Diagnosis and management of North American snake and scorpion envenomations. EBMedicine.net. 2006;8:1–28.
- Peterson CR, Gibson AR, Dorcas Snake thermal ecology: the causes and consequences of body- temperature variation. In: Seigel RA, Collins JT, eds. Snakes: Ecology and Behavior. New York: McGraw- Hill; 1993:241–314.
- Taylor EN, DeNardo DF, Malawy A comparison between point- and semi-continuous sampling for assessing body temperature in a free-ranging ectotherm. J Thermal Biol. 2004;29:91–96.
- Beaupre Time-energy use in timber rattlesnakes. In: Hayes WK, Beaman KR, Cardwell MD, Bush SP, eds. The Biology of Rattlesnakes. Loma Linda, CA: Loma Linda University Press; 2008:111–122.
- Klauber Rattlesnakes—Their Habits, Life Histories, and Influence on Mankind. 2nd ed. Berkeley, CA: University of California Press; 1972. WMS Practice Guidelines for Pitviper Envenomations 483
- Mackessy Venom composition in rattlesnakes: trends and biological significance. In: Hayes WK, Beaman KR, Cardwell MD, Bush SP, eds. The Biology of Rattlesnakes. Loma Linda, CA: Loma Linda University Press; 2008:495–509.
- Rokyta DR, Lemmon AR, Margres MJ, Aronow The venom-gland transcriptome of the Eastern diamondback rattlesnake (Crotalus adamanteus). BMC Genomics. 2012;312:1–23.
- Daltry JC, Wüster W, Thorpe Diet and snake venom evolution. Nature. 1996;379:537–540.
- Barlow A, Pook CE, Harrison RA, Wüster Coevolution of diet and prey-specific venom activity supports the role of selection in snake venom evolution. Proc R Soc B. 2009;276:2443–2449.
- Rokyta DR, Wray KP, Margres The genesis of an exceptionally lethal venom in the timber rattlesnake (Crotalus horridus) revealed through comparative venom-gland transcriptomatics. BMC Genomics. 2013;14:394.
- Minton SA, Weinstein Geographic and ontogenetic variation in the venom of the Western diamondback rattlesnake (Crotalus atrox). Toxicon. 1986;24:71–80.
- Straight RC, Glenn JL, Wolt TB, Wolfe Regional differences in content of small basic peptide toxins in the venoms of Crotalus adamanteus and Crotalus horridus. Comp Biochem Physiol B. 1991;100:51–58.
- Massey DJ, Calvete JJ, Sánchez EE, et Venom variability and envenoming severity outcomes of the Crotalus scutulatus scutulatus (Mojave rattlesnake) from Southern Arizona. J Proteomics. 2012;75:2576– 2587.
- Mackessy SP, Williams K, Ashton Ontogenetic variation in venom composition and diet of Crotalus oreganus concolor: a case of venom paedomorphosis? Copeia. 2003;4:769–782.
- Minton SA, Minton Venomous Reptiles. New York: Scribners; 1980.
- Rael ED, Lieb CS, Maddux N, Varela-Ramirez A, Perez Hemorrhagic and Mojave toxins in the venoms of the offspring of two Mojave rattlesnakes (Crotalus scutulatus scutulatus). Comp Biochem Physiol B. 1993;106:595–600.
- Du X, Clemetson Reptile C-type lectins. In: Mackessy SP, ed. Handbook of Venoms and Toxins of Reptiles. Boca Raton, FL: CRC Press; 2010:359–376.
- Mackessy Venom ontogeny in the Pacific rattlesnakes. Copeia. 1988:92–101.
- Glenn JL, Straight The rattlesnakes and their venom yield and lethal toxicity. In: Tu A, ed. Rattlesnake Venoms, Their Actions and Treatment. New York: Marcel Dekker; 1982.
- Janes DN, Bush SP, Kolluru Large snake size suggests increased snakebite severity in patients bitten by rattlesnakes in Southern California. Wilderness Environ Med. 2010;21:120–126.
- O’Neil ME, Mack KA, Gilchrist J, Wozniak Snakebite injuries treated in United States emergency departments, 2001–2004. Wilderness Environ Med. 2007;18:281–287.
- Parrish Incidence of treated snakebites in the United States. Public Health Rep. 1966;8:269–276.
- Gold BS, Dart RC, Barish Bites of venomous snakes. N Engl J Med. 2002;347:347–356.
- Langley Animal-related fatalities in the United States—an update. Wilderness Environ Med. 2005;16: 67–74.
- Forrester JA, Holstege CP, Forrester Fatalities from venomous and non-venomous animals in the United States (1999–2007). Wilderness Environ Med. 2012;23:146–152.
- Mowry JB, Spyker DA, Cantilena LR, Bailey JE, Ford Annual report of the American Association of Poison Control Centers’ national poison data system (NPDS): 30th annual report. Clin Toxicol. 2013;51:949–1229.
- Morandi N, Williams Snakebite injuries: contributing factors and intentionality of exposure. Wilderness Environ Med. 1997;8:152–155.
- Wingert WA, Chan Rattlesnake bites in Southern California and rationale for recommended treatment. West J Med. 1988;148:37–44.
- Morgan BW, Lee C, Damiano L, Whitlow K, Geller Reptile envenomation 20-year mortality as reported by US medical examiners. South Med J. 2004;97:642–644.
- Kurecki B, Brownlee Venomous snakebites in the United States. J Fam Pr
- Suchard JR, LoVecchio Envenomations by rattlesnakes thought to be dead. N Engl J Med. 1999;340:1930.
- Warrell Snake bite. Lancet. 2010;375:77–88.
- Herbert SS, Hayes Denim clothing reduces venom expenditure by rattlesnakes striking defensively at model human limbs. Ann Emerg Med. 2009;54:830–836.
- Greene The ecological and behavioral context for pitviper evolution. In: Campbell JA, Brodie ED, eds. Biology of the Pitvipers. Tyler, TX: Selva; 1992:107–118.
- Reinert HK, Cundall D, Bushar Foraging behavior of the timber rattlesnake, Crotalus horridus. Copeia. 1984:976–981.
- Gregory Communal denning in snakes. In: Seigel RA, Hunt LE, Knight JL, Zuschlag NL. Vertebrate Ecology and Systematics: A Tribute to Henry S. Fitch. Lawrence, KS: University of Kansas; 1984:57–75.
- Sexton OJ, Jacobson P, Bramble Geographic variation in some activities associated with hibernation in neartic pitvipers. In: Campbell JA, Brodie ED, eds. Biology of the Pitvipers. Tyler, TX: Selva; 1992:337–345.
- Hayes WK, Herbert SS, Rehling GC, GENNARO Factors that influence venom expenditure in viperids and other snake species during predatory and defensive contexts. In: Schuett GW, Höggren M, Douglas ME. Biology of the Vipers. Eagle Mountain, UT: Eagle Mountain Publishing; 2002:207–233.
- Minton Bites by non-native venomous snakes in the United States. Wilderness Environ Med. 1996;7:297–303.
- Michael GC, Thacher TD, Shehu The effect of prehospital care for venomous snake bite on outcome in Nigeria. Trans R Soc Trop Med Hyg. 2011;105:95–101.
- Ashton J, Baker SN, Weant When snakes bite: the management of North American Crotalinae snake envenomation. Adv Emerg Nurs J. 2011;33:15–22.
- Anz AW, Schweppe M, Halvorson J, Bushnell B, Sternberg M, Koman Management of venomous snakebite injury to the extremities. J Am Acad Orthop Surg. 2010;18:749.
- Quinn RH, Wedmore I, Johnson E, et Wilderness Medical Society practice guidelines for basic wound management in the austere environment. Wilderness Environ Med. 2014;25:295–310.
- Lavonas EJ, Ruha AM, Banner W, et Unified treatment algorithm for the management of crotaline snakebite in the United States: results of an evidence-informed consensus workshop. BMC Emerg Med. 2011;11:2.
- Wall British Military snake-bite guidelines: pressure immobilization. J R Army Med Corps. 2012;158:194–198.
- Tanen DA, Ruha AM, Graeme KA, Curry Epidemiology and hospital course of rattlesnake envenomations cared for at a tertiary referral center in central Arizona. Acad Emerg Med. 2001;8:177– 182.
- Boyer LV, Seifert SA, Clark RF, et Recurrent and persistent coagulopathy following pit viper envenomation. Arch Intern Med. 1999;159:706–710.
- Richardson WH, Goto CS, Gutglass DJ, Williams SR, Clark Rattlesnake envenomation with neurotoxicity refractory to treatment with crotaline Fab antivenom. Clin Toxicol (Phila). 2007;45:472– 475.
- Alberts MB, Shalit M, LoGalbo Suction for venomous snakebite: a study of “mock venom” extraction in a human model. Ann Emerg Med. 2004;43:181–186.
- Riggs BS, Smilkstein MJ, Kulig KW, et Rattlesnake envenomation with massive oropharyngeal edema following incision and suction. Abstract presented at: AACT/AAPCC/ABMT/CAPCC Annual Scientific Meeting; October 2, 1987; Vancouver, BC, Canada.
- Bush SP, Hegewald K, Green SM, et Effects of a negative-pressure venom extraction device [Extractor] on local tissue injury after artificial rattlesnake envenomation in a porcine model. Wilderness Environ Med. 2000;11:180–188.
- Bush SP, Hardy Immediate removal of Extractor is recommended [Letter]. Ann Emerg Med. 2001;38:607–608.
- Bush Snakebite suction devices don’t remove venom: they just suck. Ann Emerg Med. 2004;43:187–188.
- Hardy A review of first aid measures for pitviper bite in North America with an appraisal of Extractor suction and stun gun electroshock. In: Campbell JA, Brodie ED, eds. Biology of the Pitvipers. Tyler, TX: Selva Publishing; 1992:405–441.
- Johnson E, Kardong K, Mackessy Electric shocks are ineffective in treatment of lethal effects of rattlesnake envenomation in mice. Toxicon. 1987;25:1347–1349.
- Howe N, Meisenheimer Electric shock does not save snakebitten rats. Ann Emerg Med. 1988;17:254–256.
- Welch BE, Gales Use of stun guns for venomous bites and stings: a review. Wilderness Environ Med. 2001;12:111–117.
- Frank Snakebite or frostbite: what are we doing? An evaluation of cryotherapy for envenomation. Calif Med. 1971;114:25.
- Watt Poisonous snakebite treatment in the United States. JAMA. 1978;240:654–656.
- Toschlog EA, Bauer CR, Hall EL, Dart RC, Khatri V, Lavonas Surgical considerations in the management of pit viper snake envenomation. J Am Coll Surg. 2013;217:726–735.
- Theakston An objective approach to antivenom therapy and assessment of first-aid measures in snake bite. Ann Trop Med Parasitol. 1997;91:857–865.
- Amaral CF, Campolina D, Dias MB, Bueno CM, Rezende Tourniquet ineffectiveness to reduce the severity of envenoming after Crotalus durissus snake bite in Belo Horizonte, Minas Gerais, Brazil. Toxicon. 1998;36:805–808.
- Bush SP, Green SM, Laack TA, Hayes WK, Cardwell MD, Tanen Pressure immobilization delays mortality and increases intracompartmental pressure after artificial intramuscular rattlesnake envenomation in a porcine model. Ann Emerg Med. 2004;44:599–604.
- Currie BJ, Canale E, Isbister Effectiveness of pressure-immobilization first aid for snakebite requires further study. Emerg Med Australas. 2008;20:267–270.
- Meggs WJ, Courtney C, O’Rourke D, Brewer Pilot studies of pressure-immobilization bandages for rattlesnake envenomations. Clin Toxicol (Phila). 2010; 48:61–63.
- Norris RL, Ngo J, Nolan K, Hooker Physicians and lay people are unable to apply pressure immobilization properly in a simulated snakebite scenario. Wilderness Environ Med. 2005;16:16–21.
- Canale E, Isbister GK, Currie Investigating pressure bandaging for snakebite in a simulated setting: bandage type, training and the effect of transport. Emerg Med Australas. 2009;21:184–190.
- Simpson ID, Tanwar PD, Andrade C, Kochar DK, Norris The Ebbinghaus retention curve: training does not increase the ability to apply pressure immobilization in simulated snake bite—implications for snake bite first aid in the developing world. Trans R Soc Trop Med Hyg. 2008;102:451–459.
- Seifert S, White J, Currie Pressure bandaging for North American snakebite? No! Clin Toxicol (Phila). 2011;49:883–885.
- American College of Medical Toxicology; American Academy of Clinical Toxicology; American Association of Poison Control Centers; European Association of Poison Control Centres and Clinical Toxicologists; International Society on Toxinology; Asia Pacific Association of Medical Pressure immobilization after North American Crotalinae snake envenomation. Clin Toxicol (Phila). 2011;49:881–882.
- Young BA, Zahn Dry bites are real. Venom flow in rattlesnakes: mechanics and metering. J Exp Biol. 2001;204:4345–4351. WMS Practice Guidelines for Pitviper Envenomations 485
- Hayes Factors associated with the mass of venom expended by prairie rattlesnakes (Crotalus v. viridis) feeding on mice. Toxicon. 1992;30:449–460.
- Young BA, Lee CE, Daley Do snakes meter venom? BioScience. 2002;52:1121–1126.
- Russell FE, Carlson RW, Wainschel J, Osborne Snake venom poisoning in the United States. JAMA. 1975;233:341–344.
- Clark RF, Selden BS, Furbee The incidence of wound infection following crotalid envenomation. J Emerg Med. 1993;11:583–586.
- Kerrigan KR, Mertz BL, Nelson SJ, Dye Antibiotic prophylaxis for pit viper envenomation: prospective, controlled trial. World J Surg. 1997;21:369–373.
- LoVecchio F, Klemens J, Welch S, Rodriguez Antibiotics after rattlesnake envenomation. J Emerg Med. 2002;23:327–328.
- Jorge MT, Malaque C, Ribeiro LA, et Failure of chloramphenicol prophylaxis to reduce the frequency of abscess formation as a complication of envenoming by Bothrops snakes in Brazil: a double- blind randomized controlled trial. Trans R Soc Trop Med Hyg. 2004;98:529–534.
- Cowin DJ, Wright T, Cowin Long-term complications of snake bites to the upper extremity. J South Orthop Assoc. 1998;7:205–211.
- Levine M, Ruha AM, Padilla-Jones A, Gerkin R, Thomas Bleeding following rattlesnake envenomation in patients with preenvenomation use of antiplatelet or anticoagulant medications. Acad Emerg Med. 2014;21:301–337.
- Weinstein SA, Warrell DA, White J, Keyler “Venomous” bites from non-venomous snakes: a critical analysis of risk and management of “colubrid” snake bites. London: Elsevier; 2011.
- Centers for Disease Control and Prevention (CDC). Updated recommendations for use of tetanus toxoid, reduced diphtheria toxoid and acellular pertussis (Tdap) vaccine from the Advisory Committee on Immunization Practices, MMWR Morb Mortal Wkly Rep. 2011;60:13–15.
- Spano S, Vohra R, Macias Long-term complications of rattlesnake bites: a telephone survey from central California. Wilderness Environ Med. 2014;25:210–213.
- Cheng AC Management of Crotalinae (rattlesnake, water moccasin [cottonmouth], or copperhead) bites in the United Available at: www.uptodate.com. July 2012. Accessed February 26, 2015.
- Quan AN, Quan D, Curry Improving Crotalidae polyvalent immune Fab reconstitution times. Am J Emerg Med. 2010;28:593–595.
- Lavonas EJ, Chaeffer TH, Kokko J, et Crotaline Fab antivenom appears to be effective in cases of severe North American pit viper envenomation: an integrative review. BMC Emerg Med. 2009;9:13.
- Goto CS, Feng Crotalidae polyvalent immune Fab for the treatment of pediatric crotaline envenomation. Pediatr Emerg Care. 2009;25:273–282.
- Keating GM. Crotalidae polyvalent immune Biodrugs. 2011;25(2):69–76.
- Yin S, Kokko J, Lavonas E, et Factors associated with difficulty achieving initial control with Crotalidae polyvalent immune Fab antivenom in snakebite patients. Acad Emerg Med. 2010;18:46–52.
- Boyer LV, Seifert SA, Cain Recurrence phenomena after immunoglobulin therapy for snake envenomations: part 2. Guidelines for clinical management with crotaline Fab antivenom. Ann Emerg Med. 2001;37:196–201.
- Ruha AM, Curry SC, Albrecht C, Riley B, Pizon Late hematologic toxicity following treatment of rattlesnake envenomation with Crotalidae polyvalent immune Fab antivenom. Toxicon. 2011;57:53–59.
- Rampal P, Moore N, Van Ganse E, et Comparative tolerability of paracetamol, aspirin and ibuprofen for short-term analgesia in patients with musculoskeletal conditions: results in 4291 patients. J Int Med Res. 2002;30:301–308.
- Glass Early debridement in pit viper bites. JAMA. 1976;235:2513–2516.
- Huang TT, Lynch JB, Larson DL, Lewis The use of excisional therapy in the management of snakebite. Ann Surg. 1974;179:598.
- Hall Role of surgical intervention in the management of crotaline snake envenomation. Ann Emerg Med. 2001;37:175–180.
- Rossi MA, Peres LC, de Paola F, Cupo P, Hering SE, Azevedo-Marques Electron-microscopic study of systemic myonecrosis due to poisoning by tropical rattlesnake (Crotalus durissus terrificus) in humans. Arch Pathol Lab Med. 1989;113:169–173.
- Stewart RM, Page CP, Schwesinger WH, McCarter R, Martinez J, Aust Antivenin and fasciotomy/debridement in the treatment of the severe rattlesnake bite. Am J Surg. 1989;158:543–547.
- Cumpston Is there a role for fasciotomy in Crotalinae envenomations in North America? Clin Toxicol. 2011;49:351–365.
- Tanen DA, Danish DC, Clark Crotalidae polyvalent immune Fab antivenom limits the decrease in perfusion pressure of the anterior leg compartment in a porcine crotaline envenomation model. Ann Emerg Med. 2003;41:384–390.
- Tanen DA, Danish DC, Grice GA, Riffenburgh RH, Clark Fasciotomy worsens the amount of myonecrosis in a porcine model of crotaline envenomation. Ann Emerg Med. 2004;44:99–104.
- Walker JP, Morrison Current management of copperhead snakebite. J Am Coll Surg. 2011;212:470–474.
- LaMonica GE, Seifert SA, Rayburn Rattlesnake bites in pregnant women. J Reprod Med. 2010;55:520–522.
- Zugaib M, de Barros AC, Bittar RE, Burdmann EA, Neme Abruptio placentae following snake bite. Am J Obstet Gynecol. 1985;151:754–755.
- Langley Snakebite during pregnancy: a literature review. Wilderness Environ Med. 2010;21:54–486 Kanaan et al
- Offerman SR, Bush SP, Moynihan JA, Clark Crotaline Fab antivenom for the treatment of children with rattlesnake envenomation. Pediatrics. 2002;110:968–971.
- Shaw BA, Hosalkar Rattlesnake bites in children: antivenin treatment and surgical indications. J Bone Joint Surg Am. 2002;9:1624–1629.
- Trinh HH, Hack Use of CroFab antivenin in the management of a very young pediatric copperhead envenomation. J Emerg Med. 2005;29:159–162.
- Pizon AF, Riley BD, LoVecchio F, Gill Safety and efficacy of Crotalidae polyvalent immune Fab in pediatric crotaline envenomations. Acad Emerg Med. 2007;14: 373–376.
- Campbell BT, Corsi JM, Boneti C, Jackson RJ, Smith SD, Kokoska Pediatric snakebites: lessons learned from 114 cases. J Pediatr Surg. 2008;43:1338–1341.
- Schaeffer TH, Khatri V, Reifler LM, Lavonas Incidence of immediate hypersensitivity reaction and serum sickness following administration of Crotalidae polyvalent immune Fab antivenom: a meta- analysis. Acad Emerg Med. 2012;19:121–131.
- Nuchprayoon I, Pongpan C, Sripaiboonkij The role of prednisolone in reducing limb oedema in children bitten by green pit vipers: a randomized, controlled trial. Ann Trop Med Parasitol. 2008;102:643–649.
- Gawarammana IB, Kularatne SA, Dissanayake WP, et Parallel infusion of hydrocortisone þ/- chlorpheniramine bolus injection to prevent acute adverse reactions to antivenom for snakebites. Med J Aust. 2004;180:20–23.
- De Silva HA, Pathmeswaran A, Ranasinha CD, et Low-dose adrenaline, promethazine, and hydrocortisone in the prevention of acute adverse reactions to antivenom following snakebite: a randomised, double-blind, placebo-controlled trial. PLoS Med. 2011;8:e1000435.
- Schaeffer RC, Carlson RW, Puri VK, et The effects of colloidal and crystalloidal fluids on rattlesnake venom shock in the rat. J Pharmacol Exp Ther. 1978;206: 687–695.
- Jansen PW, Perkin RM, Van Stralen Mojave rattlesnake envenomation: prolonged neurotoxicity and rhabdomyolysis. Ann Emerg Med. 1992;21:322–325.
- Brooks DE, Graeme KA, Ruha AM, Tanen Respiratory compromise in patients with rattlesnake envenomation. J Emerg Med. 2002;23:329–332.
- Burgess JL, Dart Snake venom coagulopathy: use and abuse of blood products in the treatment of pit viper envenomation. Ann Emerg Med. 1991;20:795–801.
- Bhagat R, Sharma K, Sarode R, Shen Delayed massive pulmonary thromboembolic phenomenon following envenomation by Mojave rattlesnake (Crotalus scutulatus). Thromb Haemost. 2010;104:186–188.
- Bush SP, Wu VH, Corbett Rattlesnake venominduced thrombocytopenia response to Antivenin (Crotalidae) Polyvalent: a case series. Acad Emerg Med. 2000;7:181–185.
- Bush SP, Mooy GG, Phan Catastrophic acute ischemic stroke after Crotalidae polyvalent immune Fab (ovine)-treated rattlesnake envenomation. Wilderness Environ Med. 2014;25:198–203.
- Lavonas EJ, Khatri V, Daugherty C, et Medically significant late bleeding after treated crotaline envenomation: a systematic review. Ann Emerg Med. 2014;63: 71–78.
- Kitchens C, Eskin Fatality in a case of envenomation by Crotalus adamanteus initially successfully treated with polyvalent ovine antivenom followed by recurrence of defibrinogenation syndrome. J Med Toxicol. 2008;4: 180–183.
- Bush SP, Ruha AM, Seifert SA, et Comparison of F (ab’)2 versus Fab antivenom for pit viper envenomation: a prospective, blinded, multicenter, randomized clinical trial. Clin Toxicol (Phila). 2014;31:1–9







https://vk.com/@mil_med-ukuc-gaduki-xponologiya-i-pocledctviya-fotootchet